Применение углеводородов. Высокая теплота сгорания углеводородов обусловливает использование их в качестве топлива. Метан в составе природного газа находит все более широкое применение в быту и на производстве. Получило распространение применение пропана и бутана в виде "сжиженного газа", особенно в тех местностях, где нет подводки природного газа. Жидкие углеводороды используются как горючее для двигателей внутреннего сгорания в автомашинах, самолетах и т.д.
Как весьма доступный углеводород, метан все в большей степени используется в качестве химического сырья.
Реакции горения и разложения метана используются в производстве сажи, идущей на получение типографской краски и резиновых изделий из каучука. С этой целью в специальные печи вместе с метаном подают такое количество воздуха, чтобы сгорела лишь часть газа. Под действием развивающейся при горении высокой температуры другая часть разлагается, образуя тонкодисперсную сажу.
Метан - основной источник получения водорода в промышленности для синтеза аммиака и ряда органических соединений. Наиболее распространенный способ получения водорода из метана - взаимодействие его с водяным паром. Реакцию проводят в трубчатых печах при температуре около 400°C, давлении 2-3 МПа, в присутствии алюмоникелевого катализатора:
CH4 + H2O - > 3H2 + CO
Для некоторых синтезов используется непосредственно образующаяся смесь газов. Если же для последующих процессов нужен чистый водород (как в случае получения аммиака), оксид углерода (II) окисляют водяным паром, используя катализаторы.
Реакцией хлорирования получают хлорпроизводные метана. Все они находят практическое применение.
Хлорметан CH3Cl - газ. Как вещество, легко переходящее в жидкое состояние и поглощающее большое количество теплоты при последующем испарении, он применяется в качестве хладагента в холодильных установках.
Дихлорметан CH2Cl2, трихлорметан (хлороформ) CHCl3 и тетрахлорметан CCl4 - жидкости; они используются как растворители. Тетрахлорметан применяется, кроме того, при тушении огня (особенно в тех случаях, когда нельзя использовать воду), так как тяжелые негорючие пары этого вещества, образующиеся при испарении жидкости, быстро изолируют горящий предмет от кислорода воздуха.
При хлорировании метана образуется много хлороводорода. Растворяя его в воде, получают соляную кислоту.
В последнее время из метана получают ацетилен, необходимый для синтеза многих органических веществ.
Из гомологов метана при реакции изомеризации получают углеводороды разветвленного строения. Они используются в производстве каучуков и высококачественных сортов бензина. Высшие углеводороды служат исходными веществами для получения синтетических моющих средств.
Путем химической переработки предельные углеводороды часто превращают в непредельные углеводороды, химически более активные, из которых синтезируют многочисленные органические вещества.
Получение углеводородов. Предельные углеводороды в больших количествах содержатся в природном газе и нефти. Из этих природных источников и извлекают их для использования в качестве топлива и химического сырья.
В теоретическом отношении интересна реакция синтеза метана, так как она показывает возможность перехода от простых веществ к органическим соединениям. Реакция идет при нагревании углерода с водородом в присутствии порошкообразного никеля в качестве катализатора:
С + 2H2 - > CH4
Сопоставляя эту реакцию с термическим разложением метана, мы должны сделать вывод, что она обратима.
Учитывая тепловой эффект реакции, можно записать следующее уравнение:
C + 2H2 <-> CH4 + 75 кДж
На основании данного уравнения можно высказать предположение о том, какие условия способствуют сдвигу равновесия в сторону получения метана, а какие будут вызывать его разложение.
Так как синтез метана - реакция экзотермическая, то сильное нагревание не будет повышать выход продукта; равновесие сместится в сторону образования исходных веществ. При слабом нагревании будет недостаточна скорость образования метана. Поэтому оптимальная температура синтеза метана примерно 500°C, а для его разложения необходима температура свыше 1000°C.
На смещение равновесия влияет и изменение давления. Так как слева направо реакция идет с уменьшением объемов газов, то повышение давления будет способствовать образованию метана, а уменьшение - разложению его[4].
Циклопарафины
Атомы углерода в циклопарафинах (циклоалканах), как и в алканах, находятся в sp3-гибридизованном состоянии и все их валентности полностью насыщены.
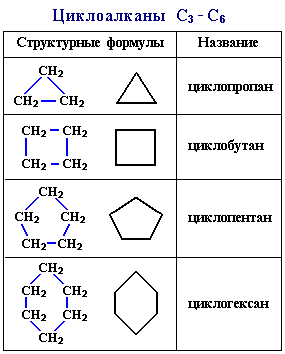
Простейший циклоалкан - циклопpопан С3Н6 - представляет собой плоский трехчленный карбоцикл.

Остальные циклы имеют неплоское строение вследствие стремления атомов углерода к образованию тетраэдрических валентных углов.

По правилам международной номенклатуры в циклоалканах главной считается цепь углеродных атомов, образующих цикл. Название строится по названию этой замкнутой цепи с добавлением приставки "цикло" (циклопропан, циклобутан, циклопентан, циклогексан и т.д.). При наличии в цикле заместителей нумерацию атомов углерода в кольце проводят так, чтобы ответвления получили возможно меньшие номера. Так, соединение
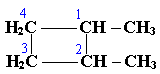
следует назвать 1,2-диметилциклобутан, а не 2,3-диметилциклобутан, или 3,4-диметилциклобутан.
Молекулы циклоалканов содержат на два атома водорода меньше, чем соответствующие алканы.
Напpимеp, бутан имеет фоpмулу С4Н10, а циклобутан - С4Н8. Поэтому общая формула циклоалканов СnH2n.
Структурные формулы циклоалканов обычно изображаются сокращенно в виде правильных многоугольников с числом углов, соответствующих числу атомов углерода в цикле[5].
Заключение
В предельных углеводородах атомы углерода находятся в первом валентном состоянии (sp3-гибpидизaция). В этом случае, как известно, все четыре гибридные орбитали в пространстве составляют геометрическую фигуру - тетраэдр (углы между осями связей С-Н равны 109° 28'). Пространственное расположение атомов в молекуле метана можно показать с помощью тетраэдрических и шаростержневых моделей. Для этого наиболее удобны объемные модели Бриглеба, которые более наглядно отражают относительные размеры атомов в молекуле. Эти модели изготовлены в соответствии с действительным соотношением радиусов атомов (в масштабе 0,05 нм = 1 см).
Основные химические превращения алканов идут только при сообщении им достаточно высокой энергии (при нагревании или облучении УФ-светом). При этом может произойти или разрыв связи С-Н с последующим замещением атома водорода на другой атом или группу атомов, или же разрыв молекулы по связи С-С. Несмотря на то что энергии этих связей равны соответственно 415-420 (для первичных углеродных атомов) и 350 кДж/моль, разрыв предпочтительнее идет по связи С-Н. Это связано с тем, что связь С-Н более доступна для реагента.
Поскольку алканы - соединения неполярные, то при разрыве связей образуются главным образом не ионы, а радикалы, т.е. этот процесс идет по гомолитическому механизму.
Список литературы
1. Максютина Н.П., Ф.Е. Каган, Л.А. Кириченко, Ф.А. Митченко. Метан. М., 2003. - 684с.
2. Роговин З.А. Основы химии. - М: Химия, 2001. - 739с.
3. Сорокин М.Ф. Химия. - М.: Химия, 2003. - 537с.
4. Химия: Справочное издание / В. Шретер. М.: Химия, 1989. - 448 с
5. Шестакова КС, Касьянова А.А. Химия. - М: Легкая индустрия, 2001,-528 с.
[1] Максютина Н. П., Ф. Е. Каган, Л. А. Кириченко, Ф. А. Митченко. Метан. М., 2003. С. 55.
[2] Шестакова КС, Касьянова А.А. Химия. - М: Легкая индустрия, 2001. С. 182.
[3] Химия: Справочное издание / В. Шретер. М.: Химия, 1989. С. 214.
[4] Сорокин М.Ф. Химия. – М.: Химия, 2003. С. 169.
[5] Роговин З.А. Основы химии.- М: Химия, 2001. С. 89.