Для механических явлений при определённых условиях выполняется закон сохранения механической энергии: полная механическая энергия системы тел сохраняется, если они взаимодействуют силами тяготения или упругости. Если действуют силы трения, то полная механическая энергия тел не сохраняется, часть её (или вся) превращается в их внутреннюю энергию.
При изменении состояния тела (системы) меняется его внутренняя энергия. Состояние тела и соответственно его внутреннюю энергию можно изменить двумя способами: в процессе теплопередачи или путём совершения внешними силами работы над телом (работа, например, силы трения). Мерой изменения внутренней энергии тела в процессе теплообмена выступает количество теплоты (Q).
Уравнение теплового баланса
В изолированной системе при смешивании горячей и холодной воды, количество теплоты Q1, отданное горячей водой, равно количеству теплоты Q2, полученному холодной водой, т.е.: |Q1|= |Q2|. Q1 (выделенное) < 0, Q2 (полученное) > 0.
Qотданное + Qполученное = 0
Записанное равенство называется уравнением теплового баланса. Определение: суммарное количества теплоты, которое выделяется в теплоизолированной системе равно суммарному количеству теплоты, которое в этой системе поглощается.
Уравнение теплового баланса связывает количество теплоты, полученное одним телом, и количество теплоты, отданное другим телом при теплообмене. При этом в теплообмене могут участвовать не два тела, а три и более: Q1 + Q2 + Q3 + … = 0
Уравнение теплового баланса
Уравнение теплового баланса – это закон сохранения энергии для процессов теплообмена в термоизолированных системах. Оно даёт возможность определить те или иные величины. В частности, значения удельной теплоёмкости веществ определяют из уравнения теплового баланса.
33. Теплоемкость – это способность поглощать некоторые объемы тепла во время нагревания или отдавать при охлаждении. Теплоемкость тела – это отношение бесконечно малого числа теплоты, что получает тело, к соответствующему приросту его температурных показателей. Величина измеряется в Дж/К. На практике применяют немного другую величину – удельную теплоемкость.
Удельной теплоемкостью вещества называется физическая величина, численно равная количеству энергии в форме теплоты, которое надо сообщить единице массы этого вещества для увеличения его температуры на 1 Кельвин (т.е. это теплоёмкость, отнесённая к единице массы вещества):
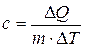
, Дж/(кг×К)
В общем случае удельная теплоемкость зависит от рода вещества и от вида термодинамического процесса, в котором телу сообщается количество теплоты.
Удельные теплоёмкости многих веществ приведены в справочниках (обычно для процесса при постоянном давлении). К примеру, удельная теплоёмкость жидкой воды при нормальных условиях — 4200 Дж/(кг·К);
льда – 2100 Дж/(кг·К).
Количество теплоты, поглощённой телом при изменении его состояния, зависит не только от начального и конечного состояний (в частности, от их температуры), но и от способа, которым был осуществлен процесс перехода между ними.
Поэтому для газов различают два вида теплоемкостей: если газ нагревают, сохраняя его объем постоянным (изохорно), говорят об удельной теплоемкости газа при постоянном объеме cV; если же газ нагревают, сохраняя постоянным его давление (изобарно), то говорят об удельной теплоемкости газа при постоянном давлении сР. У жидкостей и твёрдых тел разница между Ср и Cv сравнительно мала.
Часто пользуются молярной теплоемкостью Сμ, которая, в отличие от удельной теплоемкости, отнесена не к единице массы (1 килограмму), а к массе одного моля вещества. Очевидно, что
Cμ = mc, Дж/(моль×К)
Для газов молярную теплоемкость, рассчитанную при постоянном давлении, обозначают СР, а рассчитанную при постоянном объеме – СV. Следовательно, СР = m×cP, CV = m×cV.
Когда нагревание газа происходит при постоянном объеме, газ не совершает механической работы и все сообщаемое газу тепло идет только на увеличение его внутренней энергии DU, т.е.:
DQ = m×cV×DT = DU.
Если же нагревание газа происходит при постоянном давлении и, следовательно, объем газа увеличивается, то сообщаемое газу тепло DQ идет как на увеличение его внутренней энергии DU, так и на совершение газом работы DA над внешними телами, т.е. DQ = m×cP×DT = DU + DA.
Из сопоставления формул следует, что cP > cV, т.е. удельная теплоемкость газа при постоянном давлении больше удельной теплоемкости того же газа при постоянном объеме. При этом, согласно уравнению Майера:
CP = CV + R.
В данной работе требуется определить не абсолютные значения теплоемкостей газа, а их отношение, называемое коэффициентом Пуассона:
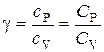
.