Содержание
1. Введение. - 3 -
2. Деструкция полимеров. - 5 -
2.1. Химическая деструкция. - 7 -
2.2. Окислительн6ая деструкция. - 14 -
2.3. Деструкция под влиянием физических воздействий. - 19 -
2.4. Термическая деструкция. - 22 -
2.5. Фотохимическая деструкция. - 26 -
2.6. Деструкция под влиянием радиоактивного излучения. - 29 -
2.7. Механохимическая деструкция. - 32 -
3. Заключение. - 35 -
Список литературы.. - 36 -
Введение
Реакциями деструкции называются реакции, протекающие с разрывом связей основной молекулярной цепи и приводящие к понижению молекулярной массы полимера без изменения его химического состава (если концевыми группами макромолекулы можно пренебречь).
Деструкция является очень важной реакцией в химии высокомолекулярных соединений. Ею пользуются для определения строения высокомолекулярных соединений, а также для получения из природных полимеров ценных низкомолекулярных веществ, например глюкозы из целлюлозы и крахмала; белков из аминокислот. Иногда деструкцию используют для частичного понижения молекулярной массы полимеров, чтобы облегчить их переработку. Например, в производстве лаков на основе эфиров целлюлозы, когда непосредственное растворение этих веществ дает слишком вязкие растворы, неудобные для нанесения покрытий, исходную целлюлозу подвергают предварительной деструкции. Частичная деструкция (пластикация) натурального каучука на вальцах облегчает его переработку в резиновые изделия. Процессы расщепления макромолекул полимеров, протекающие с образованием свободных макрорадикалов, применяют для синтеза модифицированных полимеров.
В то же время деструкция полимеров часто является нежелательной побочной реакцией при химических превращениях, переработке и использовании полимеров.
Знание механизма и основных закономерностей процессов деструкции полимеров необходимо для регулирования этой реакции, чтобы в тех случаях, когда этот процесс используют в технологии, интенсифицировать его, а при переработке и эксплуатации полимеров —свести до минимума.
Деструкция полимеров
Деструкция полимеров может протекать под действием химических агентов (воды, кислот, спиртов, кислорода и т. д.) или под влиянием физических воздействий (тепла, света, ионизирующего излучения, механической энергии и т. д.).
Химическая деструкция лучше всего изучена и наиболее характерна для гетероцепных полимеров и протекает избирательно с разрывом связи углерод—гетероатом; конечным продуктом химической деструкции является мономер. Углерод-углеродная связь значительно более стойка к действию химических агентов, поэтому химическая деструкция карбоцепных полимеров возможна только в очень жестких условиях или при наличии боковых групп, понижающих прочность связей в основной цепи полимера.
В связи с проблемой охраны окружающей среды и все более широким применением полимеров в областях, где они находятся в контакте с живыми организмами, за последние годы значительно возрос интерес к вопросу о биологической деструкции, протекающей под действием микроорганизмов, ферментов и т. д.
Деструкция полимеров под влиянием физических воздействий обычно протекает неизбирательно, так как энергетические характеристики всех химических связей довольно близки.
По характеру продуктов распада различают деструкцию по закону случая и деполимеризацию. Первый вид деструкции в известной степени напоминает процесс, обратный реакции поликонденсации; при этом образующиеся осколки велики по сравнению с размером мономерного звена. При деполимеризации, вероятно, имеет место последовательный отрыв мономеров от конца цепи, т. е. реакция, обратная росту цепи при полимеризации. Эти два вида деструкции могут протекать раздельно или одновременно.
Кроме того, возможна деструкция по слабой связи, находящейся-посередине макромолекулы.
При деструкции по закону случая молекулярная масса полимера обычно падает очень быстро, а при деполимеризации — значительно медленнее. У полиметилметакрилата с молекулярной массой 44 000, например, степень полимеризации остаточного продукта практически не меняется до тех пор, пока деполимеризация не прошла на 80 %.
Следует отметить, что при эксплуатации полимерные материалы обычно подвергаются одновременному действию различных факторов, вызывающих деструкцию. Например, термоокислительная деструкция возбуждается совместным действием тепла и кислорода, фотохимическая деструкция сопровождается гидролизом и окислением и т. д.
Деструкция высокомолекулярных соединений отличается от аналогичного процесса у низкомолекулярных веществ тем, что она, как правило, не приводит к образованию новых типов соединений. Например, глюкоза, полученная при гидролитической деструкции целлюлозы, является, так же как исходный полимер, углеводом.
Химическая деструкция
Химическая деструкция протекает под действием полярных ве-таких, как вода, кислоты, амины, спирты или кислород. Гидролиз и алкоголиз. Наиболее распространенным видом химической деструкции полимеров является гидролиз — расщепление химической связи с присоединением молекулы воды. Катализаторами процесса гидролиза служат водородные или гидроксильные ионы. Гидролиз некоторых высокомолекулярных соединений ускоряется в присутствии природных катализаторов — ферментов, избирательно действующих на некоторые связи. Склонность к гидролизу определяется природой функциональных групп и связей, входящих в состав полимера. При гидролизе боковых функциональных групп изменяется химический состав полимера; при гидролизе связей, входящих в состав основной молекулярной цепи, происходит деструкция и уменьшается молекулярная масса полимера. Концевые группы вновь образующихся молекул по своей природе не отличаются от концевых групп исходного полимера. При невысокой степени деструкции доля вновь образующихся концевых групп настолько мала, что они не влияют на химический состав поли мера и свойства полимера практически не изменяются. С повышением степени деструкции увеличивается доля концевых групп, и становится заметным их влияние на свойства полимера.
Из гетероцепных полимеров наиболее легко гидролизуются полиацетали, сложные полиэфиры, полиамиды. Большое практическое значение имеет гидролиз природных полиацеталей — полисахаридов. При их полном гидролизе образуются соответствующие моносахариды. Так, продуктом полного гидролиза крахмала и целлюлозы является глюкоза. При разрыве полуацетальной (гликозидной) связи образуются гидроксильная и альдегидная (в полуацетальной форме) группы;
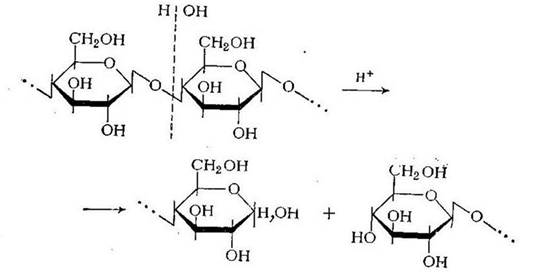
Катализаторами реакции гидролиза полисахаридов являются водородные ионы. Гидроксильные ионы не ускоряют этой реакции, благодаря чему полисахариды относительно стойки в щелочной среде и нестойки в кислой. Катализаторами реакции гидролиза полисахаридов служат также ферменты: а-глюкозидаза для крахмала и р-глюкози-даза для целлюлозы. Кислотный гидролиз крахмала применяется как промышленный метод получения глюкозы. Путем ферментативного расщепления и последующего брожения из крахмала получают этанол:
(C6H10O5)n → n/2С12Н22О11 → nС6Н12О6 → 2nC2H5OH+ 2nСО2
крахмал мальтоза глюкоза
В последнее время для получения спирта вместо пищевого сырья используют.содержащие целлюлозу отходы растительных материалов (древесные опилки, хлопковую и подсолнечную шелуху). При гидролизе этих материалов расщепляется не только целлюлоза, но и другие сопутствующие ей полисахариды. При этом получаются способные сбраживаться гексозы (глюкоза, манноза, галактоза) и несбраживаемые пен-тозы (ксилоза, арабиноза), из которых приготавливают кормовые дрожжи.
Различные полисахариды гидролизуготся с неодинаковой скоростью. К наиболее трудно гидролизуемым полисахаридам относится целлюлоза; крахмал и пентозаны гидролизуются значительно легче. Это объясняется главным образом различной физической структурой полисахаридов, а также особенностями их химического строения.
Катализаторами гидролиза полимеров, содержащих амидную связь, являются основания и кислоты.
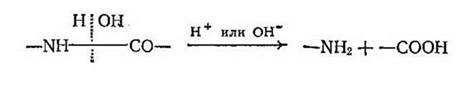 При гидролизе амидной связи образуются аминогруппа и карбоксильная группа:
При гидролизе амидной связи образуются аминогруппа и карбоксильная группа:
Катализаторами гидролиза белков служат также протеолитические ферменты (протеиназы).
Конечными продуктами гидролиза белков являются различные α-аминокислоты, синтетические полиамиды гидролизуются с образованием соответствующих дикарбоновых кислот и диаминов или исходных аминокислот.
Гидролиз и последующее исследование аминокислотного состава образующихся продуктов являются основным методом изучения строения белковых веществ. Гидролиз синтетических полиамидов находит практическое применение при использовании отходов их производства. Эти отходы гидролизуют до мономеров или низкомолекулярных полимеров и снова используют для синтеза полиамидов.
Сложные полиэфиры также гидролизуются в присутствии кислот и щелочей, причем щелочи являются более активными катализаторами. При гидролитическом расщеплении эфирной связи возникают спиртовые и кислотные концевые группы:
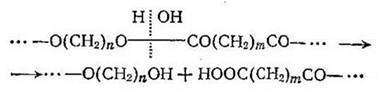
Легче всего гидролизуются полиэфиры гликолей и алифатических дикарбоновых кислот. Полиэфиры, образованные ароматическими кислотами, более устойчивы к гидролизу.
При гидролизе полиэтилентерефталата, так же как и при гидролизе целлюлозы, большую роль играет физическая структура полимера. В гетерогенной среде гидролиз полиэтилентерефталата протекает только на поверхности, причем скорость его настолько мала, что полимер практически стоек к действию кислот и щелочей. В растворе же полиэтилентерефталат гидролизуется с такой же легкостью, как низкомолекулярные эфиры терефталевой кислоты.
Гидролиз полиэфиров также может быть использован для регенерации исходных компонентов из отходов производства. Можно гидролизовать полиэтилентерефталат серной кислотой и полученный низкомолекулярный полимер или смесь мономеров повторно использовать для синтеза полиэфира.
Химическая деструкция также может быть осуществлена при помощи безводных кислот или их ангидридов — ацидолиз, аминов — аминолиз, фенолов — фенолиз и т. д.
Для синтеза полиэтилентерефталата применяют не свободную кислоту, а ее эфиры. Поэтому для расщепления отходов лучше использовать не гидролиз, а алкоголиз (гликолиз). Так, при обработке полиэтилентерефталата кипящим этиленгликолем образуется дигликолевый эфир терефталевой кислоты или низкомолекулярный полиэфир с концевыми гликолевыми группами, которые снова могут принимать участие в реакции поликонденсации:
Алкоголизу можно подвергать также полисахариды. Катализаторы реакции алкоголиза те же, что и гидролиза.
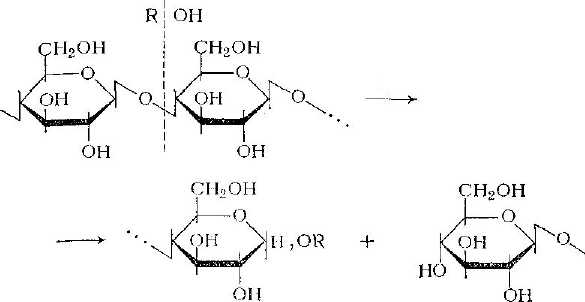 При алкоголизе полисахаридов в присутствии кислот происходит переацеталирование с разрывом связи
При алкоголизе полисахаридов в присутствии кислот происходит переацеталирование с разрывом связи
и образованием гликозидных и гидроксильной групп на концах цепей.
На расщеплении целлюлозы сверхконцентрированной соляной кислотой основан метод определения выхода глюкозы при полном гидролизе целлюлозы. Целлюлоза довольно быстро деструктируется и под действием газообразного хлористого водорода:

При обработке целлюлозы уксусным ангидридом в присутствии большого количества серной кислоты- при повышенной температуре протекает ацидолиз целлюлозы, основным продуктом которого является октаацетат целлобиозы:
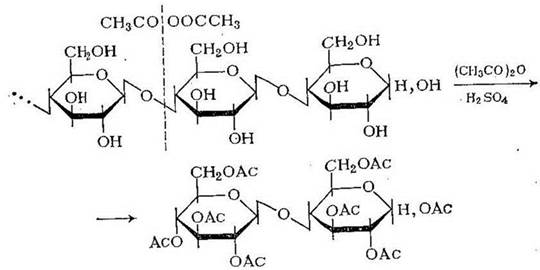
Конечным продуктом ацидолиза в этих условиях является пентаацетат глюкозы:
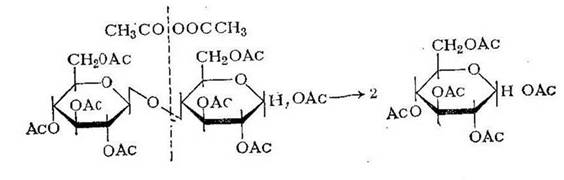
Частичный ацидолиз целлюлозы протекает и в условиях промышленного получения ацетата целлюлозы.
При действии кр1слот на полиэфиры происходит переэтерификация, а при действии на полиамиды — переамидирование. В обоих случаях процесс сопровождается деструкцией макромолекулы.
Химическая деструкция напоминает некоторые окислительно-восстановительные процессы, иногда сопровождающиеся промежуточным образованием свободных радикалов, и гидролитические реакции, протекающие под действием биологических файторов (природные ферментативные системы, микроорганизмы); при этом существенное значение имеют состав и физико-химическая структура полимерного материала: В то время как многие высокомолекулярные соединения (нитраты целлюлозы, поливинилацетат, казеин, натуральный и некоторые синтетические каучуки) подвергаются биологической коррозии, полиэтилен, полистирол, тефлон и ряд других полимеров устойчивы к ней.
Окислительн6ая деструкция
Окислительная деструкция наблюдается как у гетероцепных, так и у карбоцепных полимеров. Малая избирательность ее находит свое выражение в том, что при окислении кислородсодержащих полимеров затрагиваются наряду с валентными связями макромолекулярной цепи еще и функциональные группы и связи С—Н. Иногда происходит изменение структуры, сшивание и разветвление цепи. В частности, во время обработки поливинилового спирта азотной кислотой группы ОН окисляются до СООН с одновременной деструкцией макромолекулы:
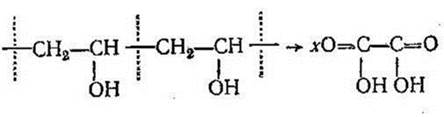
Отсутствие избирательности при термоокислительной деструкции объясняется, вероятно, тем, что процесс протекает по свободнорадикальному механизму аналогично окислению низкомолекулярных углеводородов и другим цепным реакциям свободных радикалов:
1) инициирование: RH + O=O → R· + → ·ООН (малоактивный радикал).
2) рост цепи: R· +O2 → ROO·; ROO· + R'H →ROOH + R'·;
R'· + O2 → R'OO· и т. д.
3) обрыв цепи: ROO· + ·OOR → ROOR+O2.
Так как распад гидроперекисей ROOH приводит к возникновению активных радикалов, способных отрывать водород от макромолекулы, происходит разветвление реакционной цепи, приводящее к постепенному ускорению окисления:
R—О—ОН → RO· + ·OH
+·ОН +RO·
R· + HOH ← RH → ROH + R·
Такое же ускорение наблюдается в присутствии обычных инициаторов цепной полимеризации (свободных радикалов, образующихся при их расщеплении), и ничтожных примесей металлов переменной валентности, таких, как Fe, Сu, Mn, Ni и т. д. Последние играют, по-видимому, такую же роль, как и при окислительно-восстановительной полимеризации. Ингибиторы, вызывающие обрыв цепи, тормозят окисление, и кинетические кривые окисления имеют характерную для цепных реакций S-образную форму. Как видно, поглощение кислорода начинается только после полного расходования ингибитора.
Скорость окисления ненасыщенных полимеров непосредственно связана с концентрацией перекисей, образующихся за счет присоединения кислорода по месту двойной связи или в результате реакции с а-водородом. Перекиси, разлагаясь, дают свободные радикалы, которые стабилизуются путем разрыва цепи или реакции их с еще неокисленными макромолекулами:
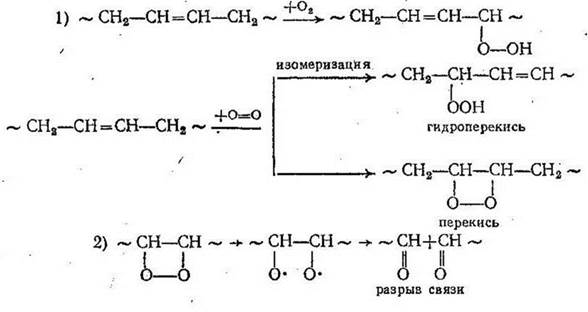
Ингибитор, не препятствуя присоединению кислорода к ненасыщенной макромолекуле, энергично связывает перекисные радикалы. Между временем окисления и расходом ингибитора может существовать линейная зависимость, пока концентрация его не превышает 1 %. Нетрудно доказать, что если концентрация кислорода по всей толщине образца каучука постоянна, то скорость инициирования равна или пропорциональна скорости ингибированного окисления.
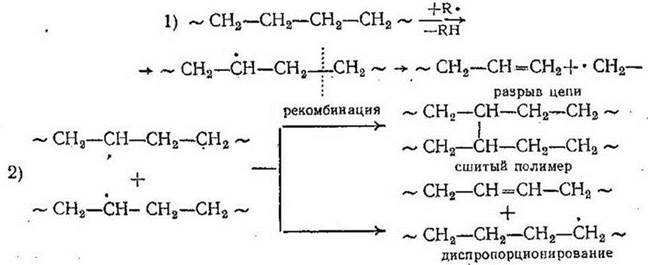 Окислительная деструкция насыщенных полимеров протекает медленнее по сравнению с ненасыщенными и может сопровождаться начальным возникновением перекисей; получающиеся при этом макрорадикалы могут давать полимерные перекиси, разлагаться с одновременным разрывом цепи, стабилизоваться путем рекомбинации или диспропорционирования:
Окислительная деструкция насыщенных полимеров протекает медленнее по сравнению с ненасыщенными и может сопровождаться начальным возникновением перекисей; получающиеся при этом макрорадикалы могут давать полимерные перекиси, разлагаться с одновременным разрывом цепи, стабилизоваться путем рекомбинации или диспропорционирования:
Ингибиторы, так же как это происходит у ненасыщенных полимеров, обрывают цепную реакцию окисления за счет взаимодействия со свободными радикалами. Если в макромолекуле имеются подвижные атомы водорода (например, когда эти атомы находятся у третичного атома углерода и активированы фенильной группой), то окисление сразу приводит к образованию перекисей:
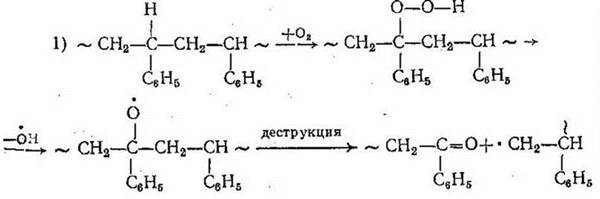
Окислительная деструкция гетероцепных полимеров детально изучена на примере целлюлозы по изменению вязкости ее растворов. Замедление процесса после достижения степени полимеризации 100—200 объясняется тормозящим влиянием альдегидных групп, образующихся при разрыве глюкозидной связи целлюлозной цепи и в первую очередь реагирующих с кислородом. Предложен следующий механизм окислительной деструкции, радикальный цепной характер которого подтверждается ускоряющим влиянием веществ, легко распадающихся на свободные радикалы (например, 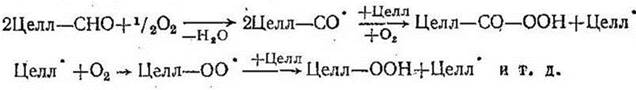 гидроокись фенилдиазония):
гидроокись фенилдиазония):
Распад макрорадикалов протекает, вероятно, так же, как и при других реакциях окислительной деструкции.