Лекция 6
Инструментальные методы исследования продуктов растительного и животного происхождения
Краткие основы титриметрических методов анализа. Общая характеристика метода. Концентрация раствора. Классификация титриметрических методов анализа. Способы титрования. Расчеты при приготовлении растворов.
Электрохимические методы исследования. Общие вопросы. Виды электродов, применяемых для анализа пищевых объектов. Примеры потенциометрических расчетов. Методы измерения рН в пищевых экстрактах. Определение минеральных составляющих сырья растительного и животного происхождения с помощью индикаторных электродов.
Объемные методы анализа
Метод количественного определения, основанный на измерении объема реагента, требующегося для проведения реакции с определенным веществом, получил название Титриметрического или объемного.
Титриметрия. Классический метод анализа, основанный на точном измерении объемов двух веществ, вступающих в химическую реакцию. Этот метод, так же как и гравиметрия, одномерны й — позволяет одновременно провести измерение только одного показателя. Это может быть один компонент или сумма каких-то конкретных компонентов (например, совместное титрование ионов кальция и магния — определение «жесткости» воды). Титриметрический метод является одним из наиболее точных методов, однако он обладает меньшей чувствительностью по сравнению с инструментальными методами, то есть не подходит для определения следовых количеств вещества.
Объемные методы основаны на протекании реакции:
1. нейтрализации,
2. осаждения,
3. ионного обмена,
4. окислительно - восстановительной и др.
Титриметрическим анализом называется метод количественного химического анализа, основанный на точном измерении объема раствора известной концентрации (титранта), израсходованного на реакцию взаимодействия с определяемым веществом (А). Титрант (В) добавляют к точно отмеренному объему анализируемого раствора небольшими порциями. Эта операция называется титрованием. Когда будет израсходовано количество титранта (В), эквивалентное количеству титруемого вещества (А), реакция закончится. Этот момент называется точкой эквивалентности (т. экв.). При этом соблюдается так называемый закон эквивалентности (закон эквивалентов - один из законов химии, согласно которому отношения масс вступающих в химическое взаимодействие веществ равны или кратны их эквивалентам химическим):
(c н V) А =(c н V) В,
где cн- молярная концентрация эквивалента, моль-экв/л; V – объем, мл.
На практике фиксируют, как правило, конечную точку титрования (к.т.т.), т. е. такой момент, когда об окончании реакции судят по изменению окраски раствора или выпадению осадка, вызываемым какими-либо из исходных соединений или продуктов реакции или специально введенными в титруемый раствор веществами - индикаторами.
Чтобы ошибка титрования была минимальной, стараются титрование проводить таким образом, чтобы к.т.т. как можно меньше отличалась от т.экв. и ошибка, связанная с этим, была не больше, чем ошибка, связанная с измерением объема титранта по бюретке (0,05 мл, т. е. одна капля).
Требования к реакциям в титриметрическом анализе.
Реакции, применяемые в титриметрическом анализе, должны удовлетворять следующим требованиям:
1. Реакция должна быть стехиометрической. Это означает, что в процессе реакции между взаимодействующими веществами должно сохраняться определенное соотношение.
2. Реакция должна протекать с достаточной скоростью, чтобы титрование можно было провести быстро.
3. Реакция должна протекать количественно. Для получения правильных результатов анализа полнота реакции в момент добавления эквивалентного количества титранта должна составлять не менее 99,9 %.
4. При титровании не должны протекать побочные реакции, делающие точное вычисление результатов анализа невозможным.
5. Необходимым условием для применения титриметрического анализа является возможность тем или иным способом фиксировать точку эквивалентности
Классификация титриметрических методов анализа
Титриметрические методы подразделяют по типу реакции, лежащей в основе метода, на четыре больших группы. Из этих групп выделяют частные методы, связанные с применением того или иного титранта (табл. 2).
Как следует из табл. 2., наибольшую группу составляют методы окислительно-восстановительного титрования. В группе методов комплексообразования широкое применение имеет комплексометрия. Методы осадительного титрования используются редко в связи с тем, что серебро – ценный металл, а соли ртути ядовиты. Большое распространение имеют методы кислотно-основного титрования.
Таблица 2.
Классификация титриметрических методов анализа
| Тип реакции | Общее название метода | Титрант | Частное название метода |
| Взаимодействие кислот и оснований | Кислотно- основное титрование | Кислота (HCl, H2SO4). Основание (KOH, NaOH) | Ацидиметрия. Алкалиметрия |
| Окисление-восстановление | Окислительно-восстановительное титрование (редоксиметрия, оксидиметрия) | KMnO4 I2,Na2S2O3 K2Cr2O7 KBrO3 NH4VO3 (NH4)2[Ce(SO4)3] TiCl3, Ti2(SO4)3 | Перманганатометрия. Иодометрия. Бихроматометрия. Броматометрия. Ванадатометрия. Цериметрия. Титанометрия |
| Осаждение | Осадительное титрование | AgNO3 NH4SCN Hg2(NO3)2 | Аргентометрия. Тиоцианометрия (Роданометрия). Меркурометрия |
| Комплексообразование | Методы комплексообразования | NaF KCN ЭДТА | Фторометрия. Цианометрия. Комплексометрия (Комплексонометрия) |
Способы титрования
В титриметрическом анализе различают прямое, обратное и косвенное титрование.
Прямое титрование. Прямое титрование основано на том, что к определенному объему определяемого компонента по каплям приливают из бюретки стандартный раствор реагента (титранта). Окончание реакции узнают по изменению окраски индикатора или другим способом. Определение содержания HClв растворе соляной кислоты с помощью NaOHпредставляет собой пример прямого титрования. Зная концентрацию раствора титранта и его количество, израсходованное на реакцию с определяемым веществом, можно легко вычислить содержание вещества (см. табл. 2.).
При анализе какого-либо вещества известны его навеска (а), объем титранта V (B), израсходованный на титрование растворенной навески (при анализе методом отдельной навески), и нормальная концентрация титранта c н(В).
При наличии таких данных массу вещества, m (А), рассчитывают по формуле:
 (г) (1)
(г) (1)
Затем по массе определяют массовую долю вещества, w(А), в навеске:
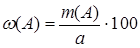 (%). (2)
(%). (2)
Пример 1. Для определения содержания Na2CO3 в содовом плаве навеска его (1,100 г) растворена в воде и полученный раствор оттитрован (0,5012 н) раствором H2SO4 с индикатором метиловым оранжевым. Чему равно содержание Na2CO3, если на титрование было израсходовано 35,00 см3 кислоты?
Решение: из условия задачи видно, что определение проведено методом прямого титрования. При титровании с метилоранжем сода оттитровывается по реакции
Na2CO3 + H2SO4 = СO2 + H2О+ Na2SO4
Используя формулу (1), получим

 г/моль экв.
г/моль экв.
По формуле (2)
 %.
%.
Обратное титрование. Если по каким-либо причинам прямое титрование невозможно (например, из-за малой скорости реакции), то применяют метод обратного титрования (титрование по остатку). Этот прием состоит в том, что к определенному объему раствора определяемого компонента приливают точно измеренный объем стандартного раствора D, взятый в избытке. Избыток не вошедшего в реакцию стандартного раствора D оттитровывают стандартным раствором B (титрантом).
Например, для определения содержания CaOк определенному объему анализируемого раствора приливают точно отмеренное количество стандартизированного раствора HCl, взятого с избытком, а затем непрореагировавший остаток HСlоттитровывают раствором NaOHизвестной концентрации.
Зная объем титранта, израсходованного на реакцию с определяемым компонентом CaO, можно вычислить содержание вещества:
 (3)
(3)
Пример 2. При определении содержания CaO в образце мела навеску в 0,1500 г обработали 50,00 мл 0,0999 М HCI, остаток кислоты оттитровали 10,00 мл NaOH (K =1,01). Вычислить массовую долю CaO в образце мела.
Решение:
CaO + 2HCI (изб.) = CaCI2 +H2O + HCI (ост.)
HCI (ост.) + NaOH = NaCl + H2O
Косвенное титрование. В некоторых случаях прибегают к особому приему титрования, называемому косвенным, или титрованием заместителя. Сущность его заключается в том, что к определенному объему анализируемого раствора прибавляют какой-либо вспомогательный реагент, реагирующий с определяемым компонентом с выделением эквивалентного количества нового вещества (заместителя), которое оттитровывают раствором титранта.
Например, K2Cr2O7определяют путем добавления к его раствору KI и H2SO4. Выделившийся в результате реакции I2 (заместитель) титруют раствором титранта Na2S2O3. При этом протекают следующие реакции:
K2Cr2O7 +6KI + 7H2SO4 =3I2 + Cr2(SO4)3 + 4K2SO4 +7 H2O
I2 + 2Na2S2O3 =2 NaI +Na2S4O6
Зная количество титранта Na2S2O3, израсходованное на реакцию сI2, количество которого эквивалентно количеству K2Cr2O7, можно вычислить содержание дихромата в анализируемом растворе.
Приготовление растворов
Стандартные растворы. В титриметрическом анализе растворы с точно известной концентрацией называют рабочими, или стандартными. Их можно приготовить несколькими способами: а) по точной навеске исходного вещества; б) по приблизительной навеске вещества с последующим определением точной концентрации (стандартизацией) приготовленного раствора по соответствующему стандартному раствору; в) по фиксаналу.
В первом способе в качестве исходных веществ для приготовления раствора можно применять только химически чистые, устойчивые соединения, состав которых строго соответствует химической формуле. Такие вещества называют установочными, или первичными стандартами. Стандартные растворы из таких веществ приготавливают растворением точной навески в воде и разбавлением полученного раствора до требуемого объема. Зная массу (m) растворенного в воде химически чистого соединения и объем (V) раствора, легко вычислить титр (Т) приготовленного раствора: Т = m / V (г/мл).
Пример 1. В 100 мл воды растворили 5,3000 г Na2CO3. Вычислить титр полученного раствора.
Решение: титр раствора равен Т = 5,3000/100 = 0,05300 г/мл.
Второй способ основан на приготовлении растворов из веществ, не удовлетворяющих перечисленным выше требованиям. В этом случае сначала готовят раствор приблизительной концентрации по навеске вещества, взятой на технических весах. Параллельно с этим готовят стандартный раствор какого-либо подходящего установочного вещества (первичный стандарт). Далее первичный стандарт титруют раствором, приготовленным по приблизительной навеске, и, зная концентрацию стандартного раствора, вычисляют концентрацию приготовленного раствора. Титрованные растворы, концентрацию которых находят в результате титрования, называются стандартизованными (или титрованными) растворами (или вторичными стандартами), а установление точной концентрации раствора титрованием называют стандартизацией раствора. Для каждого титриметрического метода разработаны методики стандартизации применяемых титрантов, даются рекомендации по выбору первичных стандартов.
Приготовление стандартного раствора из фиксанала сводится к тому, чтобы количественно перенести содержание ампулы, в которую запаяно точно дозированное количество или различных твердых веществ, или растворов известной концентрации в мерную колбу определенной емкости (чаще всего 1 л), после чего растворить вещество в дистиллированной воде и полученный раствор разбавить водой до метки.
При выполнении расчетов следует учитывать некоторые математические правила. Если точность анализа не ограничивается заранее, то следует иметь в виду, что концентрация вычисляется до четвертой значащей цифры после запятой, процентное содержание – до сотых долей. Каждый результат не может быть точнее, чем это позволяют измерительные приборы, и математическими расчетами точность анализа повысить нельзя. Лишние цифры рекомендуется округлять.
Часто в расчетах применяют поправочный коэффициент k, который показывает, во сколько раз практическая концентрация, полученная при стандартизации раствора, больше или меньше заданной (теоретической):
k = с пр. / с теор..
Тогда, с учетом поправочного коэффициента,
 .
.
При титровании окрашенных вытяжек кислот их разбавляют дистиллированной водой в два–три раза и титруют в присутствии фенолфталеина до изменения цвета вытяжки, что устанавливают сравнением с цветом такой же нетитрованной пробы (контроль). Титрование вытяжки и сравнение ее с контролем проводят на белом фоне (колбочки помещают на белый лист бумаги). Окрашенные вытяжки можно титровать щелочью в присутствии 0,1 %-го спиртового раствора тимолфталеина. Окончание титрования определяют по получению устойчивой синей окраски.
Содержание органических кислот и кислых солей (в процентах) рассчитывают по формуле:
| к = | V т K Р | 100, | ||
| V m | ||||
| э |

где Vт – объем 0,1 н. раствора NaOH, пошедшего на титрование, мл; K – коэффициент пересчета на преобладающую кислоту; Р – степень разбавления; Vэ – объем вытяжки из исследуемого продукта, взятой для титрования, мл; m – навеска продукта, г.
В процентах к преобладающей кислоте выражают кислотность плодово-ягодных соков (яблочная), маринадов (уксусная), квашеных овощей (молочная). (Часто, при определении органических кислот, встречается выражение, например, «в пересчете на яблочную кислоту». Следовательно, условно принимаем молекулярную массу всех органических кислот, определяемых в данном продукте, за молекулярную массу яблочной кислоты (2-гидроксибутановая к-та, гидроксиянтарная к-та), НООССН(ОН)СН2СООН, мол. м. 134,1 с коэффицентом для пересчета в каждой методике).
Кислотность выражается в различных единицах измерения. Кислотность продуктов, содержащих разные кислоты и значительное количество кислых солей, выражают в градусах. Под градусом кислотности понимают объем 0,1 н. раствора NaOH, необходимого для нейтрализации кислот, содержащихся в 100 г исследуемого продукта.
Кислотность муки, хлебобулочных и кондитерских изделий выражают в градусах кислотности. Под градусом кислотности понимают количество миллилитров нормальной (1 н) едкой щелочи, необходимое для нейтрализации кислот, содержащихся в 100 г исследуемого продукта.
Кислотность молочных продуктов выражают в градусах Тернера, что означает количество миллилитров 0,1 н. раствора едкой щелочи, необходимого для нейтрализации кислот, находящихся в 100 миллилитрах или 100 граммах продукта.
Кислотность жиров выражают в миллиграммах едкого калия, необходимого для нейтрализации свободных жирных кислот, находящихся в 1 г исследуемого жира.
Для непосредственного определения активности ионов находящихся в растворе (величина pН), применяют потенциометрический метод.
Потенциометрический метод относится к электрохимическим методам анализа. Электрохимические методы анализа основаны на измерении электрохимических свойств системы (потенциал, ток, количество электричества, электропроводность и др.), значения которых пропорциональны количеству определяемого вещества и зависят от его природы, т. е. связаны с его специфическими свойствами. Эти зависимости используют для количественного и качественного определения веществ.
Под электрохимической реакцией понимают гетерогенную реакцию, происходящую между отдельными частями двух соприкасающихся электропроводящих фаз (электрод - раствор), в ходе которой ионы или электроны проходят через границу раздела фаз, что вызывает протекание тока.
В электрохимических методах анализа используется электрохимическая ячейка, состоящая чаще всего из двух электродов (индикаторного или рабочего электрода и электрода сравнения), погруженных в раствор электролита.
Индикаторный электрод - это электрод, на котором протекает собственная электрохимическая реакция окисления или восстановления. Это легкополяризуемый электрод, он должен реагировать на изменение концентрации определяемого вещества:
Меn++ n  ® Meo
® Meo
Чаще всего индикаторный электрод изготавливают из Рt, Ag, Hg, а также из других материалов. В зависимости от используемого метода анализа используются те или иные типы индикаторных электродов.
Электрод сравнения - неполяризуемый электрод, потенциал его должен быть устойчивым во времени, не меняющимся при прохождении небольшого тока в момент проведения каких-либо реакций в анализируемом растворе. Относительно электрода сравнения ведется отсчет какого-либо параметра индикаторного электрода.
В качестве электродов сравнения чаще всего используют хлорсеребряный и насыщенный каломельный электроды. Хлорсеребряный электрод представляет собой серебряную проволоку или пластинку, покрытую слоем AgCl и помещенную в насыщенный раствор KCl, т. е. хлорсеребряный электрод представляет собой систему:
Сl-/ AgCl, Ag
Потенциал его при 25о С, измеренный относительно нормального водородного электрода, равен:
E = 0,222 - 0,059 lg a Cl-
Насыщенный каломельный электрод состоит из металлической ртути, каломели Hg2Cl2 и насыщенного раствора КСl:
Cl-/ Hg2Cl2, Hg
E = 0,241 - 0,059 lg aCl-
Процессы, происходящие в электрохимических ячейках при использовании электрохимических методов анализа, достаточно сложны.
Характерными особенностями электрохимических методов анализа являются: высокая чувствительность, возможность автоматизации и непрерывного контроля, экспрессность, простота оборудования, возможность использования тех же реакций, которые хорошо изучены в титриметрических методах анализа (реакции нейтрализации, окисления - восстановления, осаждения, комплексообразования), анализ окрашенных, мутных растворов, агрессивных сред и т. д., где применение цветных индикаторов для фиксирования точки эквивалентности невозможно.
Недостатком электрохимических методов анализа является сравнительно невысокая точность (≈ 1%), однако, некоторые методы (кулонометрия, электрогравиметрия) относятся к высокоточным (≈ 0,01 %).