В письме указывайте группу, Ф.И, тему.
В конспектах отделяйте одну тему от другой, дата, название темы. Раз ответ на вопрос-развернутый ответ, а не набор букв, слов и формул.
Задание выполняем полностью.
На полях тетради или на каждом листочке пишите свои Ф.И.
Лист 1.
СЛ-6.
I. Найти в интернете учебник “Химия ” 11класс, О.С. Габриелян
https://drive.google.com/file/d/0B-27Q6jc7HWRRzV0bjVhSHZlZTQ/view
II.Изучить: параграф №15 «Скорость химических реакций»,
и используя опорный конспект «Теоретические основы» (смотри ниже), составить конспект по вопросам, а затем выполнить задания (решить задачи):
1. Понятие “скорость химической реакции”.
2. Гомогенные и гетерогенные реакции (определения и примеры). Формула выражения скорости гомогенной и гетерогенной реакции.
3. Факторы, влияющие на скорость химической реакции (дать характеристику каждому фактору):
а) природа реагирующих веществ;
б) концентрация реагирующих веществ;
в) поверхность соприкосновения реагирующих веществ;
г) температура;
д) Катализатор, ингибиторы.
Теоретические основы
Химические реакции происходят во времени и поэтому характеризуются той или иной скоростью. Многие химические реакции протекают мгновенно, т.е. превращение одних веществ в другие заканчивается в десятитысячные и миллионные доли секунды. Часто скорость одной и той же химической реакции изменяется в зависимости от условий.
Чтобы судить о скорости химической реакции, надо знать, как изменяется концентрация в определенные промежутки времени. Концентрацию в данном случае выражают числом молей вещества, содержащегося в одном литре раствора. Если в течение промежутка времени (t) концентрации одного из реагирующих веществ уменьшилась от С1 до С2, то средняя скорость реакции за этот промежуток времени была:
V═ 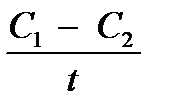
Скорость химических реакций зависит от концентрации, участвующих в них веществ, температуры, катализатора, природы реагирующих веществ,
величины поверхности соприкосновения веществ.
Давление влияет на скорость химических реакций не непосредственно через увеличение концентрации реагирующих веществ, находящихся в газообразном состоянии.
Скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ. Этот закон, открытый Гульдбергом и Ваге в 1867 году получил название закона действующих масс.
Так для реакции: А + В = С
V ═ K[A] · [Β], где
V – скорость;
К – коэффициент пропорциональности или константа скорости,
[A] и [Β] – концентрации веществ А и В.
Константа скорости – величина постоянная для данной реакции. Она не зависит от времени и концентрации, а зависит от природы реагирующих веществ и температуры.
Скорость химических реакций зависит от многих факторов. Основными из них являются природа и концентрация реагирующих веществ, давление-если в реакции участвуют газообразные вещества, поверхность соприкосновения реагирующих веществ, температура, действие катализатора.
Известно, что многие химические процессы значительно ускоряются при повышении температуры, рост которой усиливает скорость движения молекул, увеличивая тем самым число столкновений между ними.
Как правило, в большинстве случаев повышение температуры на 100 скорость увеличивается от двух до четырех раз (правило Вант – Гоффа). Число, характеризующее ускорение реакции при нагревании на 100, называется температурным коэффициентом скорости.
Vt═ Vt1 · γ 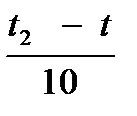 ,
,  где Vt1 – скорость реакции после повышения температуры до t2
где Vt1 – скорость реакции после повышения температуры до t2
Vt – начальная скорость реакции при температуры t1
γ - (гамма)– температурный коэффициент реакции, т.е. число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры реагирующих веществ на 10 градусов.
Примеры задач и алгоритмы их решения.
Задача 1. Запишите выражение для скорости прямой и обратной реакции в химическом уравнении: 2SO2 + O2 ↔ 2SO3
Решение.
Скорость прямой реакции V1:
V1 ═ K1[SO2]2 · [O2]
Скорость обратной реакцииV2:
V2 ═ K2[SO3]2
Задача 2. Во сколько раз изменится скорость химической реакции
2SO2 + O2 ↔ 2SO3, при повышении концентрации SO2 в 3 раза?
Решение.
Запишем уравнение скорости реакции: V1 ═ K[SO2]2 · [O2].
Если концентрацию SO2увеличить в 3 раза, то уравнение примет вид:
V2 ═ K2 [3SO2]2· [O2].
V2 ═ K29[SO2]2·[O2]
Ответ: скорость в химической реакции увеличится в 9 раз.
Задача 3. Скорость некоторой реакции при 00С равна 1 моль/л*ч, температурный коэффициент реакции – 3. Какой будет скорость данной реакции при 300С?
Решение.
Дано: Решение:
V1=1моль/л*ч,
t1=00С По правилу Вант-Гоффа
t2= 300С V2═ V1 · γ 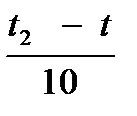 ,
, 
γ=3 Подставим значения в формулу:
___________________
Найти: V2═ 1· 3 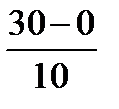 =1· 33= 27моль/л*ч,
=1· 33= 27моль/л*ч,
V2=? моль/л*ч,