В. М. Рудой, Т. Н. Останина, И. Б. Мурашова
ВВЕДЕНИЕ В ТЕОРИЮ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Учебно-методическое пособие
Екатеринбург
УрФУ
 2013
2013
УДК
ББК
В
Рецензенты:
Курганский государственный университет (зав. кафедрой физической и прикладной химии, канд. хим. наук Мосталыгина Л.В.)
Якубова Т.В. канд. хим. наук, ст. преподаватель кафедры химии и процессов горения Уральского института ГПС МЧС России
Составители В.М.Рудой, Т.Н.Останина, И.Б.Мурашова
Научный редактор В.М. Рудой
В Введение в теорию растворов электролитов: учебно-методическое пособие / В. М. Рудой, И. Б. Мурашова, Т. Н. Останина. Екатеринбург:
УрФУ, 2013. 77 с.
ISBN
В пособии рассмотрены основные положения теории растворов электролитов. Приведено описание лабораторных работ по дисциплинам «Введение в теорию растворов электролитов» и «Теоретическая электрохимия», при выполнении которых студенты приобретают навыки измерения таких свойств растворов как электропроводность, показатель кислотности рН, числа переноса, учатся рассчитывать константы диссоциации слабых электролитов, буферную емкость растворов и другие величины. Представлена последовательность выполнения лабораторных работ, анализ результатов измерений и правила оформления отчета. Учебно-методическое пособие предназначено для студентов, обучающихся по специальности 240302 – «Технология электрохимических производств», направления 240100 «Химическая технология», профиль «Технология электрохимических производств».
Библиогр.: 7 назв. Рис. 14. Табл. 10.
УДК
ББК
ISBN © Уральский федеральный университет, 2013
ОГЛАВЛЕНИЕ
Введение....................................................................................................... 4
1. Приготовление растворов и статистическая обработка результатов измерений 4
2. Теория электролитической диссоциации Аррениуса............................ 9
Лабораторная работа 1. Определение  раствора слабой кислоты 12
раствора слабой кислоты 12
Лабораторная работа 2. Определение  раствора кислоты........ 15
раствора кислоты........ 15
Лабораторная работа 3. Определение  раствора соли............... 19
раствора соли............... 19
Лабораторная работа 4. Буферные свойства растворов................ 22
3. Неравновесные явления в растворах электролитов............................... 27
Лабораторная работа №5. Закон Ома в ионных проводниках........ 29
Лабораторная работа 6. Зависимость удельной и эквивалентной
электропроводимостей от концентрации электролита................ 33
Лабораторная работа 7. Определение растворимости трудно-
растворимых солей............................................................................. 37
Лабораторная работа 8. Определение чисел переноса методом
Гитторфа.......................................................................................... 39
Лабораторная работа 9. Определение чисел переноса методом
измерения ЭДС концентрационных цепей с переносом...................... 44
4. Современные представления о растворах электролитов. Равновесные электроды 47
Лабораторная работа 10. Определение  электролита с помощью
электролита с помощью
стеклянного и хингидронного индикаторных электродов................. 50
Лабораторная работа 11. Измерение  при помощи сурьмяно-
при помощи сурьмяно-
оксидного электрода.......................................................................... 55
Лабораторная работа 12. Определение размера иона..................... 58
5. Электроаналитические методы............................................................... 61
Лабораторная работа 13. Кондуктометрическое титрование..... 63
Лабораторная работа 14. Потенциометрическое титрование..... 67
Библиографический список......................................................................... 75
Введение
Как в научных исследованиях, так и при разработке новых технологических процессов требуется проводить измерения ряда свойств растворов электролитов, таких как водородный показатель  , электропроводность и числа переноса ионов [1]. Для определения концентрации цветных и мутных растворов часто единственно возможными методами являются электрохимические методы титрования: кондуктометрия и потенциометрия [2].
, электропроводность и числа переноса ионов [1]. Для определения концентрации цветных и мутных растворов часто единственно возможными методами являются электрохимические методы титрования: кондуктометрия и потенциометрия [2].
В ходе выполнения лабораторного практикума по дисциплине «Введение в теорию растворов электролитов» студенты приобретают навыки проведения измерений свойств растворов, обработки и анализа полученных результатов.
1. ПРИГОТОВЛЕНИЕ РАСТВОРОВ
И СТАТИСТИЧЕСКАЯ ОБРАБОТКА РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ
При приготовлении растворов и проведении расчетов в физической химии и электрохимии используют различные способы выражения концентрации.
Молярная концентрация (молярность) – количество молей растворенного вещества в единице объема раствора ( ), моль/м3:
), моль/м3:
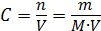 , (1.1)
, (1.1)
где  – масса растворенного вещества, кг;
– масса растворенного вещества, кг;  – молярная масса растворенного вещества, кг/моль.
– молярная масса растворенного вещества, кг/моль.
Молярная концентрация эквивалента (нормальная) – количество молей эквивалентов вещества, растворенных в единице объема раствора, моль·экв/м3:
 , (1.2)
, (1.2)
где  и
и 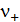 – заряд и стехиометрический коэффициент катиона в молекуле растворенного вещества.
– заряд и стехиометрический коэффициент катиона в молекуле растворенного вещества.
Моляльная концентрация (моляльность) – количество молей вещества, растворенного в одном килограмме растворителя ( ), моль/кг:
), моль/кг:
 . (1.3)
. (1.3)
Массовая доля вещества – отношение массы растворенного вещества к массе раствора в долях или процентах, %:
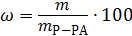 . (1.4)
. (1.4)
Титр раствора – масса растворенного вещества, растворенного в одном миллилитре раствора, г/мл:
 . (1.5)
. (1.5)
Статистическая обработка производится с целью свертывания информации и оценки величины ошибки измеряемого параметра.
При выполнении лабораторных работ обычно встречаются два вида оценивания: определение величины параметра и диапазона вероятной ошибки по серии прямых измерений и оценка параметров по результатам косвенных измерений.
Определение параметра по результатам прямых измерений
В случае, когда имеется серия измерений, так называемая выборка, в статистике используют следующие показатели:
 – количество измерений, объем выборки;
– количество измерений, объем выборки;
 – отдельное измерение;
– отдельное измерение;
 – среднее значение.
– среднее значение.
 . (1.6)
. (1.6)
 – выборочная дисперсия:
– выборочная дисперсия:
 . (1.7)
. (1.7)
 – выборочное среднеквадратическое отклонение, ошибка отдельного измерения:
– выборочное среднеквадратическое отклонение, ошибка отдельного измерения:
 . (1.8)
. (1.8)
 – среднеквадратическое отклонение среднего, ошибка результата:
– среднеквадратическое отклонение среднего, ошибка результата:
 . (1.9)
. (1.9)
Целью расчета является определения по результатам измерений диапазона, внутри которого, с определенной вероятностью, находится математическое ожидание (истинное значение) измеряемого параметра.
 , (1.10)
, (1.10)
здесь в угловых скобках символ математического ожидания измеряемого параметра,  – коэффициент Стьюдента с 5 % уровнем значимости и числом степеней свободы
– коэффициент Стьюдента с 5 % уровнем значимости и числом степеней свободы  . Коэффициент Стьюдента для соответствующего числа степеней свободы и принятого уровня значимости находят по справочным данным [3] (приложение, табл. 1). На основе полученного результата обычно делают вывод о том, что измеренное значение в пределах ошибки опыта с заданной вероятностью равно или не равно какой-то определенной величине (например, справочному значению).
. Коэффициент Стьюдента для соответствующего числа степеней свободы и принятого уровня значимости находят по справочным данным [3] (приложение, табл. 1). На основе полученного результата обычно делают вывод о том, что измеренное значение в пределах ошибки опыта с заданной вероятностью равно или не равно какой-то определенной величине (например, справочному значению).