План.
1. Состав и строение молекулы бензола.
2. Гомологический ряд аренов. Номенклатура аренов. Изомерия аренов.
3. Свойства бензола.
4. Получение и применение.
1. Ароматическими называют вещества, в молекулах которых содержится одно или несколько бензольных колец. Простейшим представителем ароматических углеводородов является бензол.
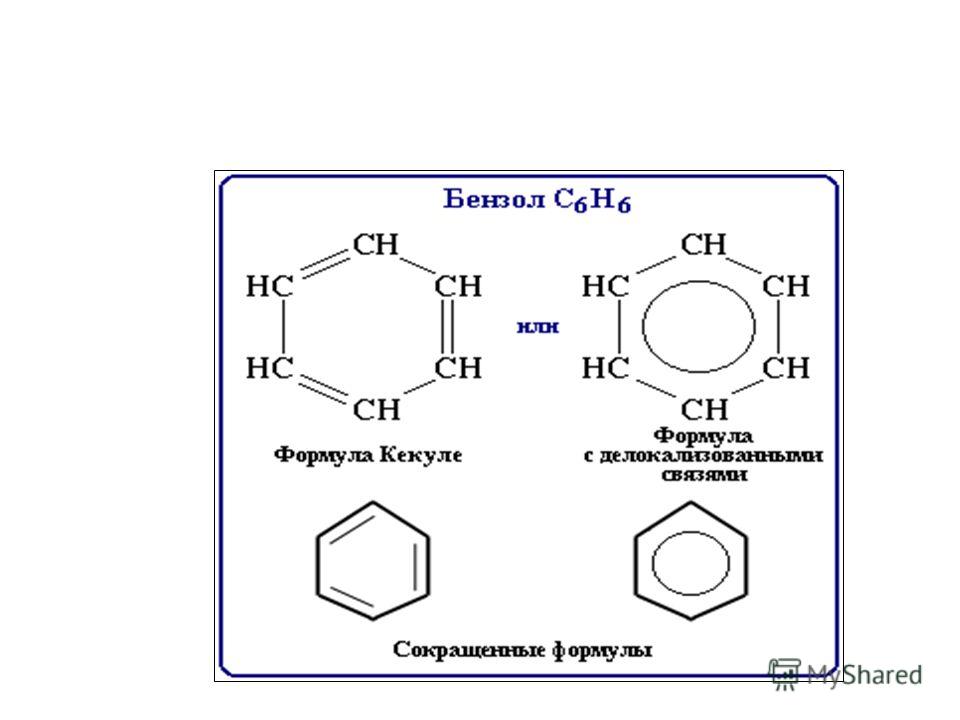
 Молекулярная формула бензола С6Н6. Особенности строения и свойств бензола удалось объяснить только благодаря представлению о гибридизации. Все шесть атомов углерода находятся в состоянии sp2 –гибридизации. Каждый из них образует две
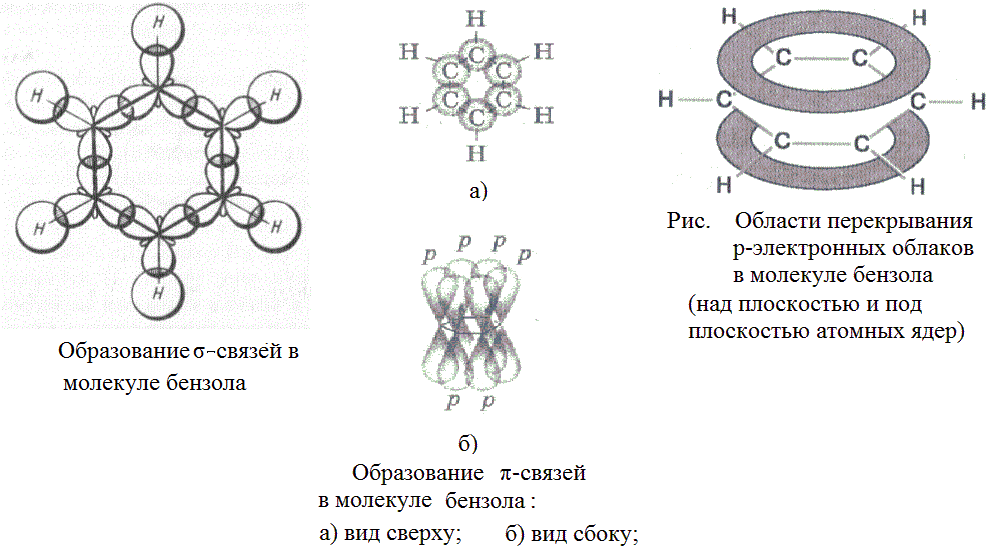
Молекулярная формула бензола С6Н6. Особенности строения и свойств бензола удалось объяснить только благодаря представлению о гибридизации. Все шесть атомов углерода находятся в состоянии sp2 –гибридизации. Каждый из них образует две  -связис двумя атомами углерода и одну - с атомом водорода. Валентные углы между этими тремя связями равны 120о и лежат в одной плоскости, шесть таких треугольников образуют правильный шестигранник. Кроме того, каждый атом углерода имеет одну негибридную р-орбиталь, которые располагаются перпендикулярно плоскости молекулы. При перекрывании этих негибридных орбиталей образуется не три локализованные пары, а единое
-связис двумя атомами углерода и одну - с атомом водорода. Валентные углы между этими тремя связями равны 120о и лежат в одной плоскости, шесть таких треугольников образуют правильный шестигранник. Кроме того, каждый атом углерода имеет одну негибридную р-орбиталь, которые располагаются перпендикулярно плоскости молекулы. При перекрывании этих негибридных орбиталей образуется не три локализованные пары, а единое 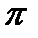 -облако из 6 электронов по форме напоминающее кольцо (точнее два кольца – над и под плоскостью углеродного скелета). В результате длина связи между атомами углерода в цикле выравнивается (она равна 0,139 нм, одинарная связь-0,154 нм, двойнаясвязь - 0,133 нм). Равноценность этих связей показывают кружком внутри цикла.
-облако из 6 электронов по форме напоминающее кольцо (точнее два кольца – над и под плоскостью углеродного скелета). В результате длина связи между атомами углерода в цикле выравнивается (она равна 0,139 нм, одинарная связь-0,154 нм, двойнаясвязь - 0,133 нм). Равноценность этих связей показывают кружком внутри цикла.
Поэтому бензол не вступает в реакции присоединения – это приводит к нарушению сопряжения, к разрыву «бензольного кольца», такие реакции возможны только в жестких условиях.
 Условно арены делят на гомологи бензола (с одним бензольным кольцом) и конденсированные арены, в которых бензольные кольца соединены друг с другом линейно или нелинейно.
Условно арены делят на гомологи бензола (с одним бензольным кольцом) и конденсированные арены, в которых бензольные кольца соединены друг с другом линейно или нелинейно.

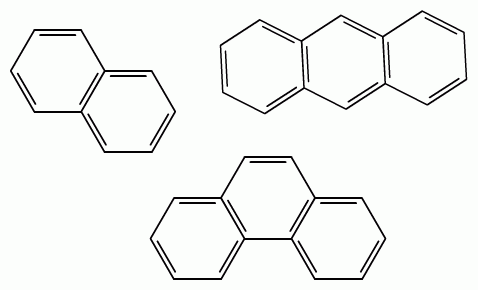 нафталин
нафталин
антрацен
фенантрен
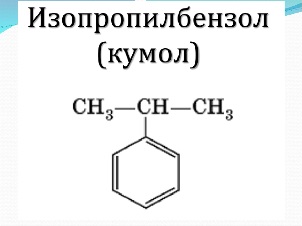
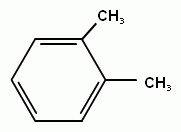
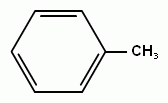
толуол (метилбензол),м-ксилол, п-ксилол, о- ксилол (1,2-диметилбензол)этилбензол, кумол (изопропилбензол)
Рассмотрим гомологический ряд бензола. Общая формула СnH2n-6. Структурная изомерия гомологов бензола обусловлена строением заместителей (начиная с С3) и взаимным расположением заместителей в кольце. Если заместитель один, то соединение не имеет изомеров, т.к. все атомы в бензольном кольце равноценны. Например: метилбензол (толуол) или этилбензол.Если с кольцом связаны два заместителя, то тут возможны три варианта, изомеры обозначаются цифрами или словами: 1,2 или о- (орто-), 1,3или м- (мета-) и 1,4 или п- (пара-). Например: о-ксилол или 1,2-диметилбензол. При отщеплении атома водорода от молекул аренов образуются радикалы, простейшие из которых фенил (С6Н5-) и бензил(С6Н5- СН2-).
Физические свойства. Первые члены ряда бензола – бесцветные подвижные жидкости со специфическим запахом. Температура кипения бензола 80оС. Они легче воды (плотность бензола 0,8) и в ней не растворяются. Хорошо растворяются в органических растворителях и сами являются хорошими растворителями.
Физиологическое действие. Бензол токсичен. Вдыхание паров бензола вызывают головную боль, потерю сознания, раздражает слизистые. Бензол легко проникает через кожу. Но особенно опасно попадание бензола в ЖКТ. Летальная доза примерно 50 мл. Он разрушает мембраны клеток, нарушает процесс синтеза белка и деления клеток. Бензол канцероген. Гомологи бензола, например, толуол и этилбензол, тоже токсичны, но меньше, чем бензол.
Химические свойства.
1) Как и все углеводороды, бензол горит. Но не очень охотно, пламя желтое, коптящее. Это связано с высоким содержанием углерода в бензоле.Реакция происходит гораздо быстрее, если бензол находится в газообразном состоянии или в виде аэрозоля:С6Н6 + О2 → СО2 + Н2О
Бензол можно окислить озоном или использовать окисление кислородом в присутствии катализатора. Но бензол не обесцвечивает раствор марганцовки. И вообще по отношению к окислителям больше напоминает алканы.
2) Ароматические углеводороды могут вступать в реакции присоединения, но эта реакцияможет проходить только за счет разрыва бензольного кольца – ароматической связи. А эта связь по прочности сравнима с сигма-связью. Т.е. реакции присоединения не характерны для бензола, они могут проходить, но только в жестких условиях. Например, гидрирование бензола идет при нагревании и высоком давлении в присутствии катализаторов (Ni, Pt).
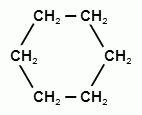
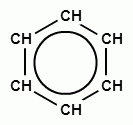
+ H2 →
Бензол при этом превращается в циклогексан. Эту реакцию называют иногда восстановлением бензола.
При взаимодействии паров хлора с бензолом под воздействием жесткого ультрафиолетового излучения, молекула бензола присоединяет три молекулы хлора и образуется твердое вещество – гексахлорциклогексан (гексахлоран). Это соединение, как и многие другие хлорпроизводные бензола, используют в сельском хозяйстве для борьбы с вредителями (насекомыми, грызунами и т.д.)

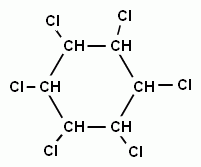

+ 3Сl2 →
4) Характерными для бензола считаются реакции замещения с галогенами, т.е. одинарная σ-связь с атомом водорода разрывается легче, чем ароматическая связь.. Но и эта реакция не протекает при Н.У. Ароматическое ядро обладает повышенной электронной плотностью и является удобным объектом для электрофильной атаки. Для аренов характерны реакции электрофильного замещения. В качестве электрофила может выступать катион хлора, образующийся из Сl2в присутствии катализатора:
Cl/:Cl + FeCl3 => Cl+ + FeCl4- ,
Реакция проходит через образование 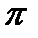 -комплекса, когда электрофильная частица притягивается к избытку электронной плотности в бензольном кольце, потом электрофил «забирает» два электрона из ароматического кольца и образует
-комплекса, когда электрофильная частица притягивается к избытку электронной плотности в бензольном кольце, потом электрофил «забирает» два электрона из ароматического кольца и образует  -связь с одним из атомов углерода бензольного кольца. При этом ароматичность структуры нарушается, а затем протон отщепляется, и ароматическая система восстанавливается. Отщепляющийся протон связывается с нуклеофильной частью реагента. В результате:
-связь с одним из атомов углерода бензольного кольца. При этом ароматичность структуры нарушается, а затем протон отщепляется, и ароматическая система восстанавливается. Отщепляющийся протон связывается с нуклеофильной частью реагента. В результате:
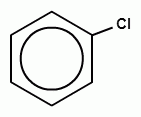
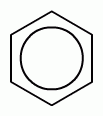
+ Сl2 →HCl +
Т.е. образуется хлорбензол. После введения хлора в бензольное кольцо оно теряет избыток электронной плотности и второй атом водорода в бензольном кольце уже не подвергается замещению (т.е. второй и далее стадий нет).
Аналогично протекают не только реакции бензола с галогенами, но и реакция нитрования, сульфирования, алкилирования (замещение водорода на углеводородный радикал – алкил, реакция Фриделя-Крафтса).
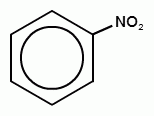

+ НО-NO2 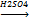 +H2O
+H2O

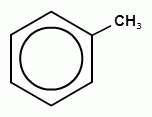
+CH3-Cl  + HCl
+ HCl
Химические свойства гомологов бензола во многом похожи на свойства бензола, но есть и отличия. Например, в реакции замещения с галогенами для толуола образуются 2-бромтолуол или 4-бромтолуол
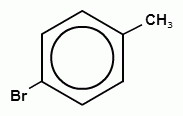
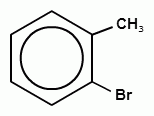

+ Br2 → HВr+ +
Т.е. мы видим, что заместитель (метил) влияет на способность бензольного кольца вступать в реакцию замещения (облегчает реакцию и направляет ее в определенное положение). Так же ведут себя и другие электродонорные заместители, например, группа –ОН или - NH2
Боковые цепи в гомологах бензола ведут себя в соответствии со своим строением, т.е. вступают в реакции замещения и присоединения. Реакции окисления протекают для гомологов бензола значительно легче, чем у бензола. Но бензольное кольцо это окисление не затрагивает, окисляются («обгорают»)боковые цепи и образуется бензойная кислота.
Получение бензола.
- Бензол входит в состав нефти и может быть получен при ее перегонке. Но этого количества недостаточно, чтобы удовлетворить потребности промышленности.
 - Бензол (и его гомологи) получают из алканов и циклоалканов, которых в нефти гораздо больше (реакция ароматизации, дегидрирования алканов). При пропускании алканов нормального строения имеющих не менее 6 атомов углерода в молекуле над нагретой платиной происходит отщепление атомов водорода и замыкание цикла а потом его ароматизация.
- Бензол (и его гомологи) получают из алканов и циклоалканов, которых в нефти гораздо больше (реакция ароматизации, дегидрирования алканов). При пропускании алканов нормального строения имеющих не менее 6 атомов углерода в молекуле над нагретой платиной происходит отщепление атомов водорода и замыкание цикла а потом его ароматизация.


 3H2+
3H2+