Современные методы диагностики и предоперационного прогнозирования состояния биологических объектов в кардиологии
П.И. Бегун2, О.В. Кривохижина1, А.В. Зяблицкий1
1 Санкт-Петербургский государственный университет аэрокосмического приборостроения
2 Санкт-Петербургский государственный электротехнический университет «ЛЭТИ» им. В.И. Ульянова (Ленина)
Modern methods of diagnosis and preoperative prediction of the state of biological objects in cardiology
P.I. Begun2, O.V. Krivohizhina1, A.V. Zyablitskiy1
1 Saint-Petersburg State University of Aerospace Instrumentation
2 Saint Petersburg Electrotechnical University «LETI»
Аннотация. Статья посвящена методам диагностики и предоперационного прогнозирования состояния биологических структур. Рассмотрен интегральный компьютерный метод, позволяющий анализировать состояние структур биологических объектов в норме, патологии и при коррекции. Для геометрического моделирования предложено применение программного пакета Mimics, в основе которого лежит использование компьютерных и магнитно-резонансных томограмм. Так как при снятии томограмм в кардиологии в связи с артефактами, обусловленными движением биологических объектов и потоком в них, изображение биологического объекта получается нечетким, то для решения этой проблемы предложен алгоритм привязки момента снятия томограмм к определенным фазам кардиоцикла.
Abstract. The article is devoted to diagnostic methods of biological structures and prediction of their preoperative state. There is considered the integral computer method which allows analyzing the biological objects’ structures in normal, pathology and correction states. For the sake of geometric modeling it is proposed to use the Mimics software package, which relies upon the computer and magnetic resonance images. Because of movements of biological objects and flows inside them the obtained tomograms in cardiology contains unclear and blurred images, so it is considered a solution which is based on the algorithm of binding tomograms to specific phases of the cardiocycles.
Ключевые слова: интегральный метод, биологическая структура, ангиограмма, томограмма, биомеханическое исследование, синхронизация
Keywords: integral method, the biological structure, angiogram, tomogram, biomechanical research, synchronization
Реферат
Статья посвящена методам диагностики и предоперационного прогнозирования состояния биологических структур. Рассмотрен интегральный компьютерный метод, позволяющий анализировать состояние структур биологических объектов в норме, патологии и при коррекции. Метод представляет собой синтез биомеханического компьютерного моделирования и анализа биологических структур по данным клинических (ангиографического, эхографического) исследований. Компьютерные модели, представленные в статье, построены в программе COSMOS при геометрическом моделировании биологических объектов в программе SolidWorks. Используемые при этом ангиограммы и эхограммы позволяют достоверно отразить объекты только в одной плоскости. Этот недостаток устраняется при использовании программного продукта Mimics. Для создания 3D модели биологического объекта в этом программном пакете используются двумерные срезы с компьютерных или магнитно-резонансных томограмм. Однако использование этого программного продукта затруднено тем, что при проведении магнитно-резонансной томографии сердца и сосудов изображение получается нечетким из-за ряда артефактов. Улучшить качество томограмм можно при более точной их синхронизации с фазами кардиоциклов.
Summary
The article is devoted to diagnostic methods of biological structures and prediction of their preoperative state. It is considered the integral computer method which allows analyzing the biological objects’ structures in normal, pathology and correction states. The proposed method is a combination of biomechanical modeling and analysis of biological structures based on clinical (angiographic, echographic) research. Presented in this article computer models are built with the help of the COSMOS software program using the geometrical modeling of biological objects from the SolidWorks software program. However, angiogram and sonogram, which are used during this modeling process, can represent reliably objects only in one dimension. This disadvantage is eliminated by using the Mimics software. To create a 3D model of a biological object in this software package, it is used two-dimensional slices of computer or MRI images. The usage complexity of this software is that once the magnetic resonance image of the heart and blood vessels is taken, the image is blurred due to a number of artifacts. A possible solution for improving the quality of tomograms is the precise synchronization with the phases of the cardiocycles.
Здоровье населения является наиболее важным показателем благосостояния государства. Являясь в значительной степени интегральным показателем, оно отражает уровень экономических и социальных тенденций в стране. Сегодняшние объективные показатели высокой заболеваемости и смертности требуют принятия срочных и неотложных мер по улучшению здоровья населения.
Данные Минздравмедпрома и Госкомстата Российской Федерации свидетельствуют о том, что в структуре причин смерти населения за последние годы первое место занимали болезни системы кровообращения (БСК) (53,1%), второе – злокачественные новообразования (16,4%), третье – травмы и отравления (14,2%). Анализ причин смерти от БСК выявил, что главная из них ишемическая болезнь сердца (ИБС) – 48.1%, а затем цереброваскулярные болезни – 36,7%, причем в сумме на их долю приходится 84,8% всех случаев смерти от заболеваний этого класса [1].
По данным ВОЗ, в мире ежегодно у 50-60 млн. человек диагностируют ИБС и одна треть всех смертей у людей в возрасте от 35 до 64 лет, что составляет более 10 млн. в год, обусловлена атеросклерозом коронарных сосудов [2].
Эффективность использования сердечно-сосудистой хирургии напрямую связана с качеством диагностики до и после операций. Современные способы анализа диагностической информации позволяют фиксировать различные элементы поведения отдельных структур организма с привязкой во времени и пространстве. Информация, получаемая такими методами визуализации, как компьютерная томография, магнитно-резонансная томография, катетеризация сердца и ангиография в подавляющем большинстве случаев используется лишь частично, и оценка ее носит качественный характер. В то же время, изображения, получаемые этими методами, несут важную информацию о природе явлений, вызванных патологическим процессом. Благодаря физико-математическому анализу у специалистов существует возможность понять закономерность функционирования биологических объектов в норме, патологии и при их коррекции. Однако возможности анализа физических взаимодействий, связанных с состоянием биологического объекта и построением конкретных моделей, лежат за пределами знания врача. В свою очередь, проведение такого анализа также не доступно специалисту, владеющему только физико-математическим аппаратом. Таким образом, необходимо объединение знаний врачей и технических специалистов и создание для обеспечения такого взаимодействия соответствующего инструментария.
Важным элементом реализации такого подхода может стать интегральный компьютерный метод, позволяющий анализировать состояние структур биологических объектов и процесс их коррекции. Он представляет собой синтез биомеханического компьютерного моделирования и анализа биологических структур по данным клинических (ангиографических, эхографических) исследований. Сложность геометрических форм исследуемых биологических объектов, неоднородность и анизотропия их конструктивных механических свойств, предопределяют использование математических моделей в рамках механики трехмерного тела и параметрических моделей, реализованных в конечно-элементном пакете CosmosWorks, интегрированного в CAD-систему Solid Works.
При построении параметрических компьютерных моделей используется программный продукт Solid Works, который позволяет, по клиническим данным, создавать геометрические модели исследуемого объекта. Для их построения в программе выполняются следующие действия: вводятся геометрические примитивы; из геометрических примитивов строятся элементарные модели структур биологического объекта; из элементарных моделей выполняется сборка исследуемого объекта.
После построения модели следующим этапом интегрального компьютерного метода является исследование этой модели. Оно проводится в рамках механики трехмерного тела с помощью метода конечных элементов. Вычисления проводятся с помощью программного пакета Cosmos Works, который интегрирован в программный продукт Solid Works, воспринимающий модели с абсолютной точностью. Прежде чем проводить исследования в программе Cosmos Works, нужно, во-первых, задавать механические свойства материала биологического объекта, граничные условия и нагрузки, а, во-вторых, разбить модель на конечные тетраэдальные прямолинейные элементы. После проведения предварительной работы вычисляются напряжения, перемещения и деформации в рассматриваемой модели и проводится ее анализ.
Интегральный метод биомеханических исследований был применен для изучения состояния структур митрального клапана при баллонной комиссуротомии и структур кровеносных сосудов с аневризмой и при стентировании [3]. Исходные геометрические параметры биологических объектов были получены по эхокардиограмме (митральный клапан) и ангиограммам (кровеносные сосуды).
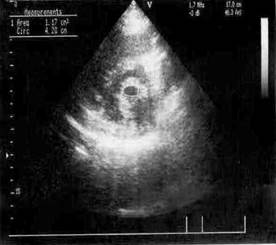
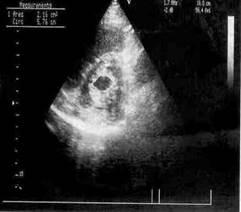
На рисунке 1 приведены эхокардиограммы митрального клапана пациента (а) до операции и (б) после операции. Геометрические параметры корректируемого предсердно-желудочкового клапана определяются планиметрически. На двумерных эхокардиограммах, снятых из парастернального доступа по длинной и короткой осям, отмечаются и обводятся курсором необходимые отрезки и контуры отверстия в момент максимального диастолического раскрытия створок клапана. Вычисления прогнозируемых результатов дилатации (увеличение или расширение какого-либо
а
| б
|
| Рис. 1. Эхокардиограммы митрального клапана пациента (а) до и (б) после дилатации |
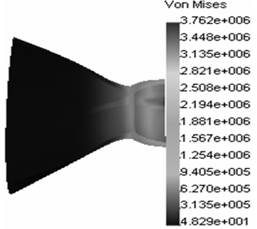
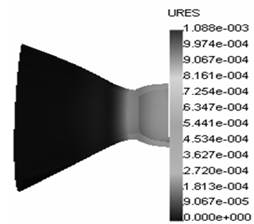
полого органа) клапана проведены при следующих геометрических и механических параметрах: площадь стенозированного отверстия митрального клапана 1,17 см2, условный радиус стенозированного отверстия 6,1 мм, условный радиус фиброзных колец 28 мм, модуль нормальной упругости створок и комиссур соответственно 20 МПа и 30 МПа, допускаемые напряжения в комиссурах митрального клапана 0,92 МПа, высота створок и комиссур 20 мм, толщина створок и ширина комиссур 1 мм, коэффициенты Пуассона створок и клапанов равны 0,4, толщина и ширина фиброзных колец 1 мм, давление в баллоне МПа. Вычисления проведены при разбиении модели митрального клапана на сто тысяч конечных элементов. На рисунке 2 приведены результаты вычислений (а) напряжений и (б) перемещений в структурах клапана.
а
| б
|
| Рис. 2. Эпюры (а) напряжений и (б) перемещений в структурах клапана |
Анализ данных эпюр напряжений и перемещений позволяет сделать вывод: расстояние от вершины митрального клапана до крайнего сечения зоны разрушения 3,4 мм; рассчитанный условный радиус дилатированного отверстия 7,44 мм; площадь дилатированного отверстия митрального клапана после проведенной эндоваскулярной операции в клинике 2,16 см2, а рассчитанного интегральным компьютерным методом составила 1,74 см2. Таким образом, использование данного метода дает погрешность расчета 19,5%, что допустимо в рамках подобных исследований.
На рисунке 3 представлены эпюры (а) напряжений и (б) деформаций сегмента сосуда с мешотчатой аневризмой при следующих геометрических и механических параметрах: длина сегмента сосуда 100 мм; диаметр сосуда 7 мм; толщина стенки сосуда 1,6 мм; длина основания аневризмы 20 мм; высота аневризмы 5 мм; толщина стенки аневризмы 2 мм; модуль нормальной упругости сосуда 0,85 МПа; модуль нормальной упругости аневризмы 2,2 МПа; давление в сосуде 1,6·104 Па (максимальное кровяное давление). Вычисления проведены при разбиении модели кровеносного сосуда с аневризмой на сто тысяч конечных элементов.
а

|
б

|
| Рис. 3. Эпюры (а) напряжений и (б) деформаций в сегменте кровеносного сосуда с мешотчатой аневризмой |
В связи с тем, что допустимое значение напряжения в аневризме 6·105 Па, а из расчета видно, что экстремальное значение напряжений в исследуемой модели сосуда с аневризмой составляет 6,028·105 Па, то можно говорить о ее критичном состоянии. В этом случае инженер выдает рекомендацию врачу – пациенту необходима операция.
Рассмотрим результаты расчета модели внутренней сонной артерии при стентировании. В процессе проведения исследований системы «сосуд-стент» используется алгоритм расчета напряженно-деформированного состояния [4], который имеет следующие особенности.
1. Для выделения зоны сохранения сосудом функциональных упругих свойств стенка модели сосуда разбивается на 10 концентрических слоев равной толщины. Упругие свойства сохраняют слои, удаленные от оси кровеносного сосуда дальше слоя, в котором возникающие напряжения по Мизесу σ ≤ [σ]ф, [σ]ф – допустимое физиологическое напряжение.
2. Давление в баллоне подбирается таким образом, чтобы радиальное перемещение стента равнялось Rc *1,05 (рекомендации эндоваскулярных хирургов).
3. При дилатации стент испытывает упругие и пластические деформации. По напряженному состоянию стента определяются величина и характер деформации. Величина упругого относительного удлинения определяет последействие стента.
4. Проводится анализ напряженного состояния в каждом из десяти слоев сосуда и определяется, в каком слое напряжение не превышает допустимого физиологического.
5. В программе SolidWorks модель сосуда перестраивается заново таким образом, чтобы можно было приложить нагрузку к внутренней стенки первого из слоев, сохранивших упругие свойства.
6. Определяется давление, при котором слой, сохранивший свои упругие свойства, лишается напряженного состояния. Это усилие, с которым стенка сосуда действует на стент.
7. Суммарное упругое последействие стента складывается из упругого последействия самого стента и перемещения стента, вызванного упругостью дилатированного сосуда.
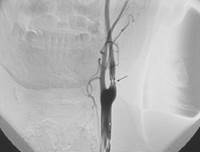
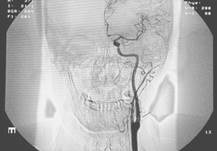
Для обоснования действенности алгоритма было проведено сопоставление результатов вычислений с клиническими данными. На рисунке 4 представлены ангиограммы внутренней сонной артерии (а) до операции и (б) после операции.
а
| б
|
| Рис. 4. Ангиограмма внутренней сонной артерии (а) до стентирования и (б) после стентирования |
Компьютерная модель внутренней сонной артерии со стентом была исследована при следующих геометрических параметрах и механических свойствах: длина сегмента сосуда 30 мм, длина бляшки 4,3 мм, диаметр сосуда 6 мм, диаметр стенозированного отверстия 2,58 мм, толщина стента 1,53 мм, модуль нормальной упругости сосуда 0,85 МПа, модуль нормальной упругости бляшки 1МПа, давление в баллоне 1,6 МПа. Вычисления проведены при разбиении модели на двести тысяч конечных элементов.
На рисунке 5 представлены эпюры (а) напряжений и (б) перемещений при дилатации сегмента сонной артерии со стентом.
а

| б

|
| Рис. 5. Эпюры (а) перемещений и (б) напряжений при дилатации сегмента сонной артерии со стентом |
Анализируя полученные результаты, можно сделать вывод о том, что диаметр стенозированного отверстия после проведенной эндоваскулярной операции составил 3,96 мм, а в результате вычислений 5,26 мм (упругое последействие стента 0,52 мм). Таким образом, погрешность расчетов составляет 32%, что в рамках данных исследований допустимо. Поскольку исходные геометрические параметры биологических объектов, по которым строились компьютерные модели, были получены на основе данных эхокардиограмм и ангиограмм, они имеют ряд недостатков, присущих данным методам диагностики. Во-первых, это ограниченный доступ к исследуемому объекту; во-вторых, получение изображения исследуемого объекта в одной плоскости; в-третьих, недостаточная разрешающая способность изображений. Для ангиографии же помимо перечисленных недостатков эхокардиографии добавляется вредное воздействие, связанное с рентгеновским излучением.
При этом традиционно для получения изображений коронарных артерий используется именно рентгеновская ангиография, которая на сегодня является «золотым стандартом» диагностики сердечно-сосудистой системы. Компьютерная и магнитно-резонансная томографии лишены указанных недостатков. На их основе в настоящее время в исследовательскую практику внедрен интерактивный программный пакет Mimics, который используется при построении 3Dмоделей. Для построения таких моделей в программе Mimicsиспользуют двумерные срезы с томограмм, которые затем могут быть напрямую переданы в другие программы (например, SolidWorks/COSMOS) для анализа методом конечных элементов.
Основная процедура по переходу к 3Dмодели – сегментация. При помощи сегментации выбирают и указывают интересующие объекты на срезах. Сегментация необходима для извлечения максимального объема данных из изображения, затем информация используется для воссоздания 3D модели. Для описания поверхностной 3Dмодели в программном пакете Mimicsприменен формат STL, позволяющий достаточно точно описать сложную, нерегулярную структуру биологического объекта для дальнейшего биомеханического анализа.
Используемые компьютерные и магнитно-резонансные томограммы содержат информацию в виде градаций серого. Mimicsпозволяет пользователю создавать модели на основании значений серого (числа Хаунсфилда), т.к. есть прямая связь между плотностью материала и значением серого на томограмме. Шкала единиц Хаунсфилда – шкала линейного ослабления излучения по отношению к дистиллированной воде, рентгеновская плотность которой при стандартных давлениии температуребыла принята за 0 HU. Диапазон единиц шкалы, соответствующих коэффициенту поглощения рентгеновского излучения нормальными анатомическими структурами организма, составляет от – 1024 HU до + 1024 HU. Отрицательные величины шкалы соответствуют воздуху и жировой ткани, положительные – мягким тканям, и более плотным материалам.
Рассмотрим два основных метода компьютерной томографии (КТ): электронно-лучевую и многослойную (мультиспиральную) КТ. Электронно-лучевая КТ обладает высокой временной разрешающей способностью (50-100 мс). Толщина среза при сканировании составляет 1,5-3 мм. У многослойной КТ временное разрешение 105-210 мс, за один оборот трубки получается 4, 8, 16, 32 или 64 среза, минимальная толщина среза составляет 0,75-1 мм. До появления возможности получать изображение с толщиной среза 0,5-1 мм оценка состояния коронарных артерий с помощью КТ была затруднена, поскольку, во-первых, из-за малого диаметра коронарных артерий (2-3 мм) качество визуализации при выполнении КТ было недостаточно высоким а, во-вторых, плотность кальцинированных бляшек сопоставима с плотностью контрастируемой крови в коронарных артериях и они плохо различимы [5].
В свою очередь, КТ имеет ряд недостатков, таких как, облучение пациента, необходимость введения при ангиографических КТ вредных йодосодержащих контрастных веществ в объеме 100-150 мл, а также затрудненная визуализация внутреннего просвета сосуда при введении контрастного вещества из-за артефактов от металлических стентов.
При проведении же магнитно-резонансной томографии (МРТ) биологических объектов рентгеновское излучение, вредное для человеческого организма, полностью отсутствует. Именно поэтому данный метод считается лучшим методом диагностики кардиопатологий, который позволяет за счет 3-D визуализации выявить структуру тканей, а также их расположение в пространстве. Преимущество МРТ состоит в использовании наклонных срезов для получения изображений, которые позволяют, в частности, точно определить истинную толщину стенок миокарда [6].
МРТ является одним из лучших методов выявления и оценки гипертрофии левого желудочка (ЛЖ). Он позволяет достоверно изучить локализацию и степень гипертрофии, оценить сократительную способность ЛЖ, выявить обструкцию выносящего тракта ЛЖ, патологическое движение передней створки митрального клапана и наличие митральной регургитации. МРТ с отсроченным контрастированием с помощью гадолиниевого контрастного препарата признана основным методом выбора для визуализации фиброзных изменений в миокарде ЛЖ. Легкие, окружающие сердце, вызывают искажение магнитного поля, тем самым затрудняя использование быстрых эхо-планарных последовательностей, которые являются стандартными для получения изображений сердца [7].
При исследовании сосудов предпочтительнее использовать МРТ сосудов с контрастом (ангиография) – метод, во время которого естественная контрастность всех тканей выражена достаточно хорошо, но, несмотря на это, все-таки происходят ситуации, требующие использования особых парамагнитных контрастных веществ для повышения точности диагностики [5].
Лучевые методы диагностики заболеваний сердца в последнее время становятся все более актуальными благодаря совершенствованию оборудования и программного обеспечения [7]. Однако эти методы сопряжены с влиянием ряда артефактов, в частности, с артефактами движения сердца, кровеносных сосудов и потока крови. Для устранения этих артефактов необходимо проводить синхронизацию томографических изображений сердца и сосудов с кардиоциклом. Поскольку при томографии сканирование производится непрерывно, либо пошагово, сбор данных может происходить в течение всего кардиоцикла или в его определенных фазах. Предпочтительно осуществлять МРТ-съемку в конце диастолы, т. к. в этот период происходит расширение полостей сердца из-за расслабления мышц предсердий и желудочков. Решение задачи точной синхронизации кардиоциклов, т.е. временной привязки к их характерным точкам, позволило бы осуществить более эффективную привязку моментов получения томограмм к определенным фазам сердечных сокращений.
Таким образом, одной из основных задач, которые необходимо решить для получения точных и достоверных данных при использовании интегрального метода, в том числе с применением магнитно-резонансных томограмм, является разработка алгоритмов высокоточной синхронизации, обладающих достаточной степенью универсальности и гибкости для получения нужных изображений.
В большинстве случаев синхронизацию электрокардиосигнала (ЭКС) осуществляют по R-зубцу, поскольку он обычно имеет наибольшую амплитуду. Кроме того, исключая некоторые виды патологий, R-зубец всегда присутствует в ЭКС. На практике обычно пользуются стандартными алгоритмами синхронизации, опирающимися на какой-то один сигнальный признак R-зубца. Большинство этих алгоритмов давно и подробно описаны. Алгоритмы детектирования R-зубца по используемому в них сигнальному признаку, можно разделить на следующие группы:
- использующие абсолютные величины исходного сигнала;
- использующие корреляционные алгоритмы;
- основанные на дифференциальных методах;
- структурные алгоритмы;
- использующие цифровую фильтрацию;
- основанные на частотном анализе исходных данных;
- логические алгоритмы;
- смешанные.
Поскольку каждая группа алгоритмов использует какой-либо определенный сигнальный признак для обнаружения R-зубца, то каждый алгоритм более устойчив к одним видам помех и менее устойчив к другим.
При разработке алгоритмов синхронизации для метода электрокардиографии сверхвысокого разрешения (ЭКГ СВР) была поставлена задача эффективного совместного автоматизированного анализа заданного набора последовательностей кардиоциклов ЭКС, что потребовало существенного повышения точности временно́й синхронизации каждого из них. Поскольку существующие методы решения данной проблемы не отличаются высокой точностью, надежностью и эффективностью и не позволяют, ввиду вариабельности сердечного ритма, производить эффективный синхронный анализ кардиоциклов вне ближайшей окрестности R-зубца, то именно эта задача является одной из составляющих комплекса новых технических решений при практической реализации метода ЭКГ СВР [8] (нс)[1].
Из рассмотренных, самым простым, требующим минимальных вычислительных затрат, алгоритмом детектирования и временно́го позиционирования R-зубцов является алгоритм порогового амплитудного детектора. Суть его работы сводится к отысканию локальных максимумов на всем интервале анализируемого ЭКС. Достоинством указанного алгоритма является простота его реализации, связанная с минимальным объемом вычислений, что позволяет легко реализовать анализ в реальном времени. Наряду с этим алгоритм обладает низкой точностью и плохой устойчивостью к влиянию помех и изменчивости ЭКС, поэтому его эффективная работа на практике очень затруднена.
Был также исследован корреляционный алгоритм, в котором на первом этапе его реализации находят значения функции взаимной корреляции функции сравнения и отрезков исходной функции ЭКС той же длительности, что и функция сравнения. При этом положение функции сравнения, которая специально подбирается для вычисления функции взаимной корреляции, постепенно смещается от начала исследуемого отрезка ЭКС к его концу. Таким образом, появляется возможность построить взаимнокорреляционную функцию на всем протяжение кардиоцикла, однако требуется произвести масштабирование для приведения ее к диапазону значений [‑1,1], т.е. к коэффициенту взаимной корреляции. Данную функцию можно использовать для принятия решения о том, найдена точка ЭКС, на которую настроен алгоритм, или нет. Этот алгоритм имеет более высокую, по сравнению с амплитудным пороговым детектором, устойчивость к помехам и изменчивости кардиосигнала и может с легкостью детектировать R-зубцы даже при их весьма сильном искажении шумами, поскольку не опирается на абсолютные значения исходного сигнала при принятие решения о положение искомой точки синхронизации. Данный алгоритм обладает еще одним достоинством – возможностью его адаптации под индивидуальную форму ЭКС конкретного пациента путем подбора и адаптивной настройки функций сравнения. Более подробные исследования данного алгоритма приведены в статье [9].
На рисунке 6 представлены соотношение результатов детектирования R зубца различными алгоритмами, используемыми в настоящее время на практике. Цифрами обозначены: 1 - положение R-зубца по результатам
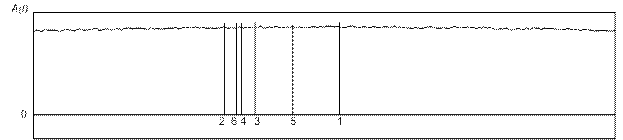
Рис. 6. Соотношение результатов детектирования R зубца различными алгоритмами синхронизации
анализа амплитудным пороговым детектором (описан ранее); 2 - положение R-зубца по результатам анализа корреляционным алгоритмом (описан ранее); 3 - положение R-зубца по результатам анализа алгоритмом корреляционной свертки; 4 - положение R-зубца по результатам анализа алгоритмом поиска «центра тяжести»; 5- положение R-зубца по результатам анализа алгоритмом Пана-Томкинса; 6 - положение R-зубца по результатам анализа алгоритмом спектрального анализа.
В результате проведенного в рамках данной работы анализа эффективности применения существующих алгоритмов определения временного положения R-зубцов для синхронизации экспозиций МРТ-изображений, предлагается использовать комплексный статистический алгоритм оценки положения характерных точек ЭКС, разработанный ранее [9], как предпочтительный для использования при реализации метода ЭКГ СВР. Суть его работы сводится к использованию результатов анализа нескольких других алгоритмов, в том числе и перечисленных ранее, для выработки среднестатистической оценки положения R-зубца. Такой подход позволяет минимизировать ошибки фиксации временного положения и уменьшить вероятность ложного обнаружения R-зубца. Кроме того, результат работы этого алгоритма не зависит от конкретного сигнального признака, а опирается, в той или иной степени, сразу на несколько признаков, за счет чего повышается точность результатов синхронизации. Расчет положения R-зубца по комплексному алгоритму требует разработки оптимальных процедур, учитывающих все полученные отдельные оценочные значения и их показатели надежности и достоверности путем введения для них соответствующих весовых коэффициентов. Это дает возможность гибкой настройки комплексного алгоритма под конкретные условия работы путем варьирования различных весовых коэффициентов, что позволяет настроить алгоритм оптимальным образом под форму ЭКС конкретного пациента.
При выборе наиболее предпочтительной привязки МРТ-изображений важную роль должны сыграть методики детального анализа всех характерных точек и описания полной структуры кардиоцикла [10] (нс).
Еще одной важной задачей, которая может быть решена при использовании метода ЭКГ СВР благодаря высокой точности определения положения характерных точек ЭКС, большим значениям частоты дискретизации и разрядности АЦП, является разработка алгоритмов синхронизации для пациентов с мерцательной аритмией, частотной желудочковой экстрасистолией, тахиаритмией и тахикардией. Такие задачи до сих пор не имели решения.
Использование комплексного алгоритма синхронизации ЭКС для решения задачи синхронизации магнитнорезонансного томографа с фазами кардиоцикла приведет к существенному улучшению качества МРТ-изображений, позволит проводить более точную предоперационную диагностику состояния биологических структур пациента и поможет врачам принимать правильные решения.
Литература:
1. Бокерия Л.А., Кайли А.Е.Организация реабилитации пациентов с сосудистыми заболеваниями. Бюллетень НЦССХ им. А.Н. Бакулева РАМН. – СПб.,2009, №3. С.15-18
2. Светликов А.В., Гамзатов Т.Х., Андреев В.В. Методы эндоваскулярного лечения заболеваний сосудов. Амбулаторная хирургия. Материалы II международной конференции «Проблемы современной ангиологии – 2005». С. 20-24.
3. Бегун П.И., Кривохижина О.В., Сухов В.К. Компьютерное моделирование и биомеханический анализ критического состояния коррекции структур сосудистой системы. Информационно-управляющие системы. СПб. 2005, № 6. – С. 51-56 (часть 1).
4. Кривохижина О.В. Информационное обеспечение предоперационного прогнозирования состояния сосудов в системе «Артериальные кровеносные сосуды». Автореферат дисс. на соискание уч. степени канд. техн. наук. СПб: СПБГЭТУ «ЛЭТИ», 2007 г.
5. Синицын В.Е. Терновой С.К. Магнитно-резонансная томография в новом столетии. Радиология-практика. – 2005, № 4. – С. 17-22.
6. Беленков Ю.Н., Терновой С.К., Синицын В.Е. Магнитно-резонансная томография сердца и сосудов. М.: Видар, 1997. – 142 с.
7. Ринкк П.А. Магнитный резонанс в медицине. – М.: Геотар-Мед, 2003. – 156 с.
8. Гуляев Ю.В. Зайченко К.В. Электрокардиография сверхвысокого разрешения: задачи, проблемы и перспективы. //Настоящий сборник.
9. К.В. Зайченко, А.В. Зяблицкий. Высокоточная синхронизация электрокардиосигналов сверхвысокого разрешения. Известия высших учебных заведений России. Радиоэлектроника. СПб. 2010. № 1.
10. Кузнецов А.А. Киселев Н.Н., Гуменный В.Г. Методы поиска характерных точек электрокардиосигнала и статистического анализа его морфологии. //Настоящий сборник.
Краткие сведения об авторах
1. Бегун Петр Иосифович, доктор технических наук, профессор кафедры прикладной механики и инженерной графики Санкт-Петербургского государственного электротехнического университета «ЛЭТИ» В.И. Ульянова (Ленина), 197376, Санкт-Петербург, ул. Профессора Попова, д. 5, e-mail begun@fromru.com
2. Кривохижина Оксана Владимировна, кандидат технических наук, доцент кафедры медицинской радиоэлектроники Санкт-Петербургского государственного университета аэрокосмического приборостроения (ГУАП), 190000, Санкт-Петербург, ул. Большая Морская, д. 67, e-mail krivohizhinaov@gmail.com
3. Зяблицкий Александр Валерьевич, инженер кафедры медицинской радиоэлектроники Санкт-Петербургского государственного университета аэрокосмического приборостроения (ГУАП), 190000, Санкт-Петербург, ул. Большая Морская, д. 67
Author’s data
1. Begun Peter Iosifovich, Doctor of Engineering, professor of chair of applied mechanics and engineering graphics of the St. Petersburg state electrotechnical university "LETI" of V.I.Ulyanov (Lenin), 197376, St. Petersburg, Professor Popov St., 5, e-mail: begun@fromru.com
2. Krivokhizhina Oksana Vladimirovna, Candidate of Technical Sciences, associate professor of medical radio electronics of St. Petersburg State University of Aerospace Instrumentatin (GUAP), 190000, St. Petersburg, Bolshaya Morskaya St., 67, e-mail: krivohizhinaov@gmail.com
3. Zyablitskiy Alexander Valeryevich, engineer of chair of medical radio electronics of St. Petersburg State University of space instrument making (GUAP), 190000, St. Petersburg, Bolshaya Morskaya St., 67.
[1] (нс) – настоящий сборник