· К. п. д. тепловой машины:
η = A/ Q1 = 1 – Q2/Q1,
где Q 1 - тепло, получаемое рабочим телом; Q2 - отдаваемое тепло.
· К.п.д. цикла Карно:
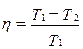 ,
,
где T 1, T 2 - температуры нагревателя и холодильника.
· Неравенство Клаузиуса:

где δ Q - элементарное тепло, полученное системой.
· Приращение энтропии системы:

· Основное уравнение термодинамики для обратимых процессов:
T d S = d U + p d V
· Свободная энергия:
F = U - TS, A T = - Δ F
· Связь между энтропией и статистическим весом Ω (термодинамической вероятностью):
S = k∙ lnΩ,
где k - постоянная Больцмана.
3.1. У тепловой машины, работающей по циклу Карно, температура нагревателя в п = 1,6 раза больше температуры холодильника. За один цикл машина производит работу А = 12 кДж. Какая работа за цикл затрачивается на изотермическое сжатие вещества? (Рабочее вещество - идеальный газ.)
Ответ: А' = А/(п - 1) = 20 кДж.
3.2. В каком случае к.п.д. цикла Карно повысится больше: при увеличении температуры нагревателя на Δ Т или при уменьшении температуры холодильника на такую же величину?
Ответ: при уменьшении температуры холодильника Т 2.
3.3. Водород совершает цикл Карно. Найти к.п.д. цикла, если при адиабатическом расширении:
а) объем газа увеличивается в п = 2,0 раза;
б) давление уменьшается в n = 2,0 раза.
Ответ: a) η = 1 – n1-γ = 0,25; б) η = 1 – n1/(γ-1) = 0,18
3.4. Холодильная машина, работающая по обратному циклу Карно, должна поддерживать в своей камере температуру — 10° Спри температуре окружающей среды 20° С. Какую работу надо совершить над рабочим веществом машины, чтобы отвести от ее камеры Q2 = 140 кДж тепла?
Ответ: А' = Q 2(T 1/ T 2 - 1) = 16 кДж.
3.5. Тепловую машину. работающую по циклу Карно с к.п.д. η 10% используют при тех же тепловых резервуарах как холодильную машину. Найти ее холодильный коэффициент ε.
Ответ: ε = (1 - η)/η = 9
3.6. Найти к.п.д. цикла, состоящего из двух изобар и двух адиабат, если в пределах цикла давление изменяется в п раз. Рабочее вещество идеальный газ с показателем адиабаты γ.
Ответ: η = 1 – η-(γ - 1)/γ.
3.7. Идеальный газ с показателем адиабаты γ, совершает цикл, состоящий из двух изохор и двух изобар. Найти к.п.д. такого цикла, если температура Т газа возрастает в п раз как при изохорическом нагреве, так и при изобарическом расширении.
Ответ: η = 1 – (n + γ)/(1 + γ n).
3.8. Идеальный газ совершает цикл, состоящий из:
а) изохоры, адиабаты и изотермы;
б) изобары, адиабаты и изотермы,
причем изотермический процесс происходит при минимальной температуре цикла. Найти к.п.д. каждого цикла, если температура в его пределах изменяется в п раз.
Ответ: в обоих случаях η = 1 – ln n /(n - 1)
3.9. Идеальный газ с показателем адиабаты γ совершает прямой цикл, состоящий из адиабаты. изобары и изохоры. Найти к.п.д. цикла, если при адиабатическом процессе объем идеального газа:
а) увеличивается в n раз:
б) уменьшается в n раз.
Ответ: a) η = 1 – γ(n – 1)/(n γ – 1); б) η = 1 – (n γ – 1)/γ(n – 1) n γ–1.
3.10. Воспользовавшись неравенством Клаузиуса, показать, что к.п.д. всех циклов, у которых одинакова максимальная температура Т maxи одинакова минимальная температура Т min, меньше, чем у цикла Карно при Т max и Т min. Указание: Учесть, что неравенство ∫δ Q 1/ T 1 - ∫δ Q′ 2 /T 2 ≤ 0 только усиливается при замене Т 1на Т max и Т 2на Т min.
3.11. Какую максимальную работу может произвести тепловая машина, если в качестве нагревателя используется кусок железа массы m = 100 кг с начальной температурой Т 1 =1500 К. а в качестве холодильника вода океана с температурой Т 2 = 285 К?
Ответ: А max = mc [ T 1 – T 2 – T 2∙ln(T 1/ T 2)] = 34 МДж, где с - удельная теплоемкость железа.
3.12. В качестве основных переменных, характеризующих состояние тела, можно принять его температуру и энтропию. Изобразить графически цикл Карно на диаграмме, откладывая по оси абсцисс энтропию, а по оси ординат температуру. Вычислить с помощью этого графика к.п.д. цикла.
3.13. Найти изменения энтропии моля идеального газа при изохорическом, изотермическом и изобарическом процессах.
3.14. Найти изменение энтропии при переходе 80 г кислорода от объема 10 л при температуре 80о C к объему в 40 л при температуре 300о C.
Ответ: 
3.15. Один кубический метр воздуха, находящегося при температуре 0оC и давлении 19,6 Н/cм2, изотермически расширяется от объема V 1 до объема V 2 = 2 V 1. Найти изменение энтропии при этом процессе.
Ответ: 
3.16. Доказать, что энтропия v молей идеального газа может быть представлена в виде: S = v [ cV ln T + R ln(V / v) + const], где аддитивная постоянная в скобках не зависит от числа частиц газа.
3.17. В двух сосудах одного и того же объема находятся различные идеальные газы. Масса газа в первом сосуде m 1во втором – m 2, давление газов и температуры их одинаковы. Сосуды соединили друг с другом, и начался процесс диффузии. Определить суммарное изменение Δ S энтропии рассматриваемой системы, если относительная молекулярная масса первого газа μ1, а второго μ2.
Ответ: Δ S = R ln2(m 1/μ1 + m 2/μ2).
3.18. Теплоизолированный цилиндрический сосуд разделен поршнем пренебрежимо малой массы на две равные части. По одну сторону поршня находится идеальный газ с массой m, относительной молекулярной массой μ и молярными теплоемкостями Cp и Сv,не зависящими от температуры, а по другую сторону поршня создан высокий вакуум. Начальные температура и давление газа T 0 и p 0. Поршень отпускают, и он, свободно двигаясь, дает возможность газу заполнить весь объем цилиндра. После этого, постепенно увеличивая давление на поршень, медленно доводят объем газа до первоначальной величины. Найти изменение внутренней энергии н энтропии газа при таком процессе.
Ответ: Δ U = U - U 0 = (m /η)∙ CVT 0(2γ-1 - 1);
ΔS = S - S 0 = (m /μ)∙ CV (γ - 1)ln2.
3.19. Зная зависимость свободной энергии от температуры и объема F(T, V), показать, что давление р = -(дF/дV)T и энтропия S = -(дF/д T) V.
3.20. Наряду с внутренней энергией U и свободной энергией F в термодинамике широко используют функции Н = U + рV - энтальпию и Ф = F + рV - свободную энергию Гиббса. Доказать, что эти функции удовлетворяют соотношениям:
| dU = TdS – pdV, | dF = -SdT – pdV, | ||
| d Ф = -SdT + Vdp, | dH = TdS + Vdp, | ||

| 
| 
| |
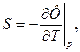
| 
| 
| |

| 
| ||
3.21. Доказать соотношения Максвелла:
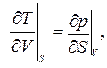
| 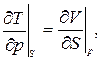
|

| 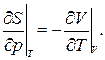
|
3.22. В чем ошибочность следующего рассуждения? Элементарное количество тепла dQ,полученное физически однородным телом при квазистатическом процессе, равно
dQ = dU + pdV = dH – Vdp,
или 
Отсюда 



Приравнивая оба выражения, получим (∂ V /∂ T)p= 0. Отсюда следует, что тепловое расширение тел невозможно.
3.23. Показать, что внутренняя энергия вещества с уравнением состояния в форме р = f (V)T не зависит от объема.
3.24. Внутренняя энергия и единицы объема является функцией только от T, а уравнение состояния газа имеет вид р = и (Т) / 3Определить функциональную форму и (Т).
Ответ: u (T) = const T 4 - (фотоновый газ)
3.25. Для идеального электронного газа имеет место соотношение: PV = 2/3 U. Найти для этого газа уравнение адиабаты: а) в переменных (Р, V); б) в переменных (V, Т).
Ответ: а) РV 5/3 = const; б) TV 2/3 = const.
3.26. Показать, что для веществ, у которых давление является линейной функцией температуры Т, теплоемкость Сv не зависит от объема.
3.27. Используя соотношения Максвелла найти выражение для энтропии моля газа Ван-дер-Ваальса.
Ответ: 
3.28. Вычислить плотность энтропии S поля теплового излучения.
Ответ: S =4/3 aT 3+const. (см. задачу 2.32).
3.29. Найти отношение средних квадратичных скоростей молекул гелия и азота при одинаковых температурах.
Ответ: 
3.30. Определить температуру смеси CO2 и H2, если разность средних кинетических энергий на одну молекулу того и другого газа равна 2,07·10-14 эрг. Газ считать идеальным.
Ответ:  300оК.
300оК.
3.31. N атомов газообразного гелия находятся при комнатной температуре в кубическом сосуде объемом 1,0 см3. (Cреднее время пролета атомов гелия расстояния порядка размера сосуда τ ~ 10-5 c).Найти:
а) вероятность того, что все атомы соберутся в одной половине сосуда;
б) примерное числовое значение N, при котором это событие можно ожидать на протяжении t = 1010 лет (возраст Вселенной).
Ответ: a) p = 1/2N ; б) N = 1g (t/τ)/ 1g 2 = 80. где
3.32. Найти статистический вес наиболее вероятного распределения N = 10 одинаковых молекул по двум одинаковым половинам сосуда. Определить вероятность такого распределения.
Ответ: Ω вер = N!/[(N /2)!]2=252, p N/2 = Ω вер /2N = 24,6%.
3.33. Какое количество тепла необходимо сообщить макроскопической системе, находящейся при температуре Т = 290 K, чтобы при неизменном объеме ее статистический вес увеличился на Δη = 0,1%?
Ответ: δ Q = kT Δη = 4·10-23 Дж.
3.34. Один моль идеального газа, состоящего из одноатомных молекул, находится в сосуде при температуре T 0= 300 K. Как и во сколько раз изменится статистический вес этой системы (газа), если ее нагреть изохорически на Δ T = 1,0 K?
Ответ: Увеличится в Ω/Ω0 = (1 + Δ T / T 0) iNa/2 = 101,31·10ˆ21 раз.