Билет №1 (3)
Выведите молекулярную формулу вещества, если массовая доля углерода в нём составляет 82,75%, водорода 17,25%. Относительная плотность паров по воздуху равна 2.
| Дано: | Решение: |
| Dвозд(CxHy) = 2 ω(C) = 82,75% ω(H) = 17,25% | 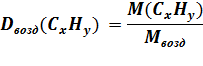 Mвозд = 29 г/моль
M(CxHy) = 29 г/моль ∙ 2 = 58 г/моль
Пусть ν(CxHy) = 1 моль, тогда m(CxHy) = 58 г
Mвозд = 29 г/моль
M(CxHy) = 29 г/моль ∙ 2 = 58 г/моль
Пусть ν(CxHy) = 1 моль, тогда m(CxHy) = 58 г
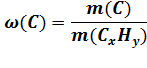 m(C) = 0,8275 ∙ 58г = 47,995 ≈ 48г
m(H) = 0,1725 ∙ 58г = 10,005 ≈ 10г
ν(C): ν(H) =
m(C) = 0,8275 ∙ 58г = 47,995 ≈ 48г
m(H) = 0,1725 ∙ 58г = 10,005 ≈ 10г
ν(C): ν(H) =  = 4: 10 ⇒ С4Н10
M(C4H10) = 48 + 10 = 58 г/моль = 4: 10 ⇒ С4Н10
M(C4H10) = 48 + 10 = 58 г/моль
|
| CxHy –? | Ответ: С4Н10 |
Билет №2 (3)
Осуществить превращения:
Натрий → гидроксид натрия → карбонат натрия → хлорид натрия → нитрат натрия
Na  NaOH
NaOH  Na2CO3
Na2CO3  NaCl
NaCl  NaNO3
NaNO3
0 +1 -2 +1 -2 +1 0
1. 2Na + 2H2O → 2NaOH + H2↑
в-ль ок-ль
Na0 – 1e- → Na+1 | 2
2H+1 + 2e- → H2 | 1
2. 2NaOH + CO2 → Na2CO3 + H2O
2Na+ + 2OH– + CO2 → 2Na+ + CO32– + H2O
2OH– + CO2 → CO32– + H2O
3. Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
2Na+ + CO32– + 2H+ + 2Cl– → 2Na+ + 2Cl– + CO2↑ + H2O
CO32– + 2H+ → CO2↑ + H2O
4. NaCl + AgNO3 → NaNO3 + AgCl↓
Na+ + Cl– + Ag+ + NO3– → Na+ + NO3– + AgCl↓
Cl– + Ag+ → AgCl↓
Билет №3 (3)
Какой объём хлора прореагирует с натрием массой 34,5г. Определить массу хлорида натрия.
| Дано: | Решение: |
| m(Na) = 34,5г | 34,5 г x л y л
2Na + Cl2 → 2NaCl
2 моль 1 моль 2 моль
46 г 22,4 л 117 г
m = M ∙ ν V = Vm ∙ ν
M(Na) = 23 г/моль
M(NaCl) = 58,5 г/моль
m(Na) = 23 г/моль ∙ 2 моль = 46 г
m(NaCl) = 58,5 г/моль ∙ 2 моль = 117 г
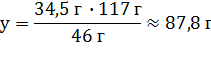 Vm = 22,4 л/моль
V(Cl2) = 22,4 л/моль ∙ 1 моль = 22,4 л
Vm = 22,4 л/моль
V(Cl2) = 22,4 л/моль ∙ 1 моль = 22,4 л

|
| V(Cl2) –? m(NaCl) –? | Ответ: V(Cl2) = 16,8 л; m(NaCl) = 87,8 г |
Билет №4 (3)
Осуществить превращения:
Магний → хлорид магния → гидроксид магния → оксид магния → сульфат магния
Mg  MgCl2
MgCl2  Mg(OH)2
Mg(OH)2  MgO
MgO  MgSO4
MgSO4
0 +1 -1 +2 -1 0
1. Mg + 2HCl  MgCl2 + H2↑
MgCl2 + H2↑
в-ль ок-ль
Mg0 – 2e- → Mg+2 | 1
2H+ + 2e- → H20 | 1
2. MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl
Mg2+ + 2Cl– + 2Na+ + 2OH– → Mg(OH)2↓ + 2Na+ + 2Cl–
Mg2+ + 2OH– → Mg(OH)2↓
3. Mg(OH)2  MgO + H2O
MgO + H2O
4. MgO + H2SO4 → MgSO4 + H2O
MgO + 2H+ + SO42– → Mg2+ + SO42– + H2O
MgO + 2H+ → Mg2+ + H2O
Билет №5 (3)
Какой объём хлора прореагирует с железом массой 400г, если массовая доля примесей в нём 20%?
| Дано: | Решение: |
| mобр(Fe) = 400 г ωприм = 20% | 320 г x л
2Fe + 3Cl2 → 2FeCl3
2 моль 3 моль
112 г 67,2 л
 mприм = 0,2 ∙ 400 г = 80 г
m(Fe) = mобр – mприм = 400 г – 80 г = 320 г
M(Fe) = 56 г/моль;
m(Fe) = 56 г/моль ∙ 2 моль = 112 г
Vm = 22,4 л/моль
V(Cl2) = Vm ∙ ν = 22,4 л/моль ∙ 3 моль = 67,2 л
mприм = 0,2 ∙ 400 г = 80 г
m(Fe) = mобр – mприм = 400 г – 80 г = 320 г
M(Fe) = 56 г/моль;
m(Fe) = 56 г/моль ∙ 2 моль = 112 г
Vm = 22,4 л/моль
V(Cl2) = Vm ∙ ν = 22,4 л/моль ∙ 3 моль = 67,2 л

|
| V(Cl2) –? | Ответ: V(Cl2) = 192 л |
Билет №6 (3)
Осуществить превращения:
Медь → хлорид меди (II) → гидроксид меди (II) → оксид меди (II) → медь
Cu  CuCl2
CuCl2  Cu(OH)2
Cu(OH)2  CuO
CuO  Cu
Cu
0 0 +2 –1
1. Cu + Cl2 → CuCl2
в-ль ок-ль
Cu0 – 2e- → Cu+2 | 1
Cl2 + 2e- → 2Cl– | 1
2. CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Cu2+ + 2Cl– + 2Na+ + 2OH– → Cu(OH)2↓ + 2Na+ + 2Cl–
Cu2+ + 2OH– → Cu(OH)2↓
3. Cu(OH)2  CuO + H2O
CuO + H2O
+2 –2 0 t 0 +1 –2
4. CuO + H2  Cu + H2O
Cu + H2O
ок-ль в-ль
Cu+2 + 2e- → Cu0 | 1
H20 – 2e- → 2H+1 | 1
Билет №7 (3)
При прокаливании 300 г известняка, содержащего 10% примесей, получено 75 г негашеной извести. Найти массовую долю выхода продукта реакции от теоретически возможного.
| Дано: | Решение: |
| mобр(CaCO3) = 300г ωприм = 10% mпракт(CaO) = 75г | 270 г x г
CaCO3  CaO + CO2
1 моль 1 моль
100 г 56 г CaO + CO2
1 моль 1 моль
100 г 56 г
 mприм = 300 г ∙ 0,1 = 30 г
m(CaCO3) = 300 г – 30 г = 270 г
mприм = 300 г ∙ 0,1 = 30 г
m(CaCO3) = 300 г – 30 г = 270 г
 = 151,2 г — mтеор(CaO) = 151,2 г — mтеор(CaO)
 = 0,496 =
= 49,6% = 0,496 =
= 49,6%
|
| η(CaO) –? | Ответ: η(CaO) = 49,6 % |
Билет №8 (3)
Какова масса соли, получившейся в результате взаимодействия 100 г соляной кислоты с 14 г оксида кальция?
| Дано: | Решение: |
| m(HCl) = 100 г m(CaO) = 14 г | 0,25 моль х моль
CaO + 2HCl → CaCl2 + H2O
1 моль 2 моль 1 моль


 m = M ∙ ν
M(CaCl2) = 40 + 71 = 111 г/моль
m(CaCl2) = 111 г/моль ∙ 0,25 моль = 27,75 г ≈ 27,8 г
m = M ∙ ν
M(CaCl2) = 40 + 71 = 111 г/моль
m(CaCl2) = 111 г/моль ∙ 0,25 моль = 27,75 г ≈ 27,8 г
|
| m(CaCl2) –? | Ответ: m(CaCl2) = 27,8 г |
Билет №9 (3)
Какой объём ацетилена необходимо сжечь для получения 24 л оксида углерода (IV)?
| Дано: | Решение: |
| V(CO2) = 24 л | x л 24 л
2C2H2 + 5O2 → 4CO2 + 2H2O
2V 4V

|
| V(C2H2) –? | Ответ: V(C2H2) = 12 л |
Билет №10 (3)
Осуществить превращения:
Гидроксид меди (II) → сульфат меди (II) → медь →
→ оксид меди (II) → нитрат меди (II)
CuO  CuSO4
CuSO4  Cu
Cu  CuO
CuO  Cu(NO3)2
Cu(NO3)2
1. CuO + H2SO4 → CuSO4 + H2O
CuO + 2H+ + SO42– → Cu2+ + SO42– + H2O
CuO + 2H+ → Cu2+ + H2O
+2 +6 –2 0 +2 +6 –2 0
2. CuSO4 + Fe → FeSO4 + Cu
ок-ль в-ль
Cu2+ + 2e– → Cu0 | 1
Fe0 – 2e– → Fe2+ | 1
0 0 t +2 –2
3. 2Cu + O2 → 2CuO
в-ль ок-ль
Cu0 – 2e– → Cu+2 | 2
O20 + 4e– → 2O–2 | 1
4. CuO + 2HNO3 → Cu(NO3)2 + H2O
CuO +2H+ + 2NO3– → Cu2+ + 2NO3– + H2O
CuO +2H+ → Cu2+ + H2O
Билет №11 (3)
Какой объём ацетилена можно получить из образца карбида кальция массой 100 г, если массовая доля примесей в нём 15%?
| Дано: | Решение: |
| mобр(CaC2) = 100 г ωприм = 15% | 85 г x г
CaC2 + 2H2O → C2H2 + Ca(OH)2
1 моль 1 моль
64 г 22,4 л
 mприм = 0,15 ∙ 100 г = 15 г
m(CaC2) = mобр – mприм = 100 г – 15 г = 85 г
M(CaC2) = 40 + 24 = 64 г/моль
m(CaC2) = 64 г/моль ∙ 1 моль = 64 г
Vm = 22,4 л/моль
V(C2H2) = Vm ∙ ν = 22,4 л/моль ∙ 1 моль = 22,4 л
mприм = 0,15 ∙ 100 г = 15 г
m(CaC2) = mобр – mприм = 100 г – 15 г = 85 г
M(CaC2) = 40 + 24 = 64 г/моль
m(CaC2) = 64 г/моль ∙ 1 моль = 64 г
Vm = 22,4 л/моль
V(C2H2) = Vm ∙ ν = 22,4 л/моль ∙ 1 моль = 22,4 л

|
| V(C2H2) –? | Ответ: V(C2H2) = 29,8 л |
Билет №12 (3)
Осуществить превращения:
Железо → хлорид железа (II) → гидроксид железа (II) → сульфат железа (II) → хлорид железа (II)
Fe  FeCl2
FeCl2  Fe(OH)2
Fe(OH)2  FeSO4
FeSO4  FeCl2
FeCl2
0 +1 –1 +2 –1 0
1. Fe + 2HCl → FeCl2 + H2
в-ль ок-ль
Fe0 – 2e– → Fe+2 | 1
2H+1 + 2e– → H20 | 1
2. FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Fe2+ + 2Cl– + 2K+ + 2OH– → Fe(OH)2↓ + 2K+ + 2Cl–
Fe2+ + 2OH– → Fe(OH)2↓
3. Fe(OH)2 + H2SO4 → FeSO4 + 2H2O
Fe(OH)2 + 2H+ + SO42– → Fe2+ + SO42– + 2H2O
Fe(OH)2 + 2H+ → Fe2+ + 2H2O
4. FeSO4 + BaCl2 → FeCl2 + BaSO4↓
Fe2+ + SO42– + Ba2+ + 2Cl– → Fe2+ + 2Cl– + BaSO4↓
SO42– + Ba2+ → BaSO4↓
Билет №13 (3)
Вычислите массу соли, образованной при взаимодействии уксусной кислоты массой 120 г и гидроксида натрия массой 60 г?
| Дано: | Решение: |
| m(CH3COOH) = 120 г m(NaOH) = 60 г | 1,5 моль х моль
CH3COOH + NaOH → CH3COONa + H2O
1 моль 1 моль 1 моль
 = 2 моль в избытке
M(CH3COOH) = 60 г/моль
M(NaOH) = 40 г/моль = 2 моль в избытке
M(CH3COOH) = 60 г/моль
M(NaOH) = 40 г/моль
 = 1,5 моль в недостатке = 1,5 моль в недостатке
 m = M ∙ ν
M(CH3COONa) = 82 г/моль
m(CH3COONa) = 82 г/моль ∙ 1,5 моль = 123 г
m = M ∙ ν
M(CH3COONa) = 82 г/моль
m(CH3COONa) = 82 г/моль ∙ 1,5 моль = 123 г
|
| m(CH3COONa) –? | Ответ: m(CH3COONa) = 123 г |
Билет №14 (3)