 По своим физическим свойствам и молекулярной структуре твёрдые тела разделяются на два класса – аморфные и кристаллические тела.
По своим физическим свойствам и молекулярной структуре твёрдые тела разделяются на два класса – аморфные и кристаллические тела.
| (а) |
 Твёрдые тела, в которых атомы или молекулы расположены упорядоченно и образуют периодически повторяющуюся внутреннюю структуру, называются кристаллами (см. рис. 1а). Физические свойства кристаллических тел неодинаковы в различных направлениях (это свойство кристаллов называется анизотропностью), но совпадают в параллельных направлениях. Анизотропия механических, тепловых, электрических и оптических свойств кристаллов объясняется тем, что при упорядоченном расположении атомов, молекул или ионов силы взаимодействия между ними и межатомные расстояния оказываются неодинаковыми по различным направлениям.
Твёрдые тела, в которых атомы или молекулы расположены упорядоченно и образуют периодически повторяющуюся внутреннюю структуру, называются кристаллами (см. рис. 1а). Физические свойства кристаллических тел неодинаковы в различных направлениях (это свойство кристаллов называется анизотропностью), но совпадают в параллельных направлениях. Анизотропия механических, тепловых, электрических и оптических свойств кристаллов объясняется тем, что при упорядоченном расположении атомов, молекул или ионов силы взаимодействия между ними и межатомные расстояния оказываются неодинаковыми по различным направлениям.
| (б) |
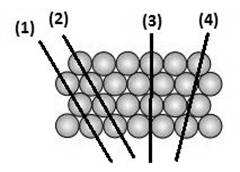
| Рис. 1 |
Физические свойства кристаллического тела, представленного на рисунке, совпадают вдоль прямых
1) (1) и (3) 2) (3) и (4)
3) (1) и (2) 4) (2) и (3)
Конец формы
Начало формы
Изотропия физических свойств аморфных тел объясняется тем, что в аморфном теле
1) межатомные расстояния неодинаковы по различным направлениям
2) межатомное взаимодействие больше межатомного взаимодействия в кристаллах
3) межатомное взаимодействие меньше межатомного взаимодействия в кристаллах
4) межатомные расстояния в среднем одинаковы по различным направлениям
Конец формы
Начало формы
На рисунке представлены процессы нагревания с переходом в жидкое состояние для четырёх веществ, первоначально находившихся в твёрдом состоянии.

Какой график соответствует аморфному состоянию твердого тела? Ответ поясните.
Изотропия физических свойств аморфных тел объясняется тем, что в аморфном теле
1) межатомные расстояния неодинаковы по различным направлениям
2) межатомные расстояния в среднем одинаковы по различным направлениям
3) межатомное взаимодействие больше межатомного взаимодействия в кристаллах
4) межатомное взаимодействие меньше межатомного взаимодействия в кристаллах
Как замерзают растворы1
Если охладить раствор какой-либо соли в воде, то обнаружится, что температура кристаллизации понизилась. Кристаллики появятся в жидкости лишь при температуре на несколько градусов ниже нуля градусов.
Температура кристаллизации зависит от концентрации раствора. Она тем ниже, чем выше концентрация раствора. Например, при растворении 45 кг поваренной соли в 1 м3 воды температура кристаллизации уменьшается до –3 °С. Самую низкую температуру имеет насыщенный раствор, т. е. раствор, содержащий максимально возможное количество растворённой соли. При этом уменьшение температуры достаточно существенное. Так, насыщенный раствор поваренной соли в воде кристаллизуется при температуре –21 °С, а насыщенный раствор хлористого кальция – при температуре –55 °С.
Рассмотрим, как идёт процесс кристаллизации. После того как
в растворе появятся первые кристаллики льда, концентрация раствора повысится. Возрастёт относительное число молекул соли, увеличатся помехи процессу кристаллизации воды, и температура кристаллизации понизится. Если дальше не понижать температуру, то кристаллизация остановится. При дальнейшем понижении температуры кристаллики воды продолжат образовываться, и раствор станет насыщенным. Дальнейшее обогащение раствора растворённым веществом (солью) становится невозможным, и раствор застывает сразу. Если рассмотреть замёрзшую смесь в микроскоп, то можно увидеть, что она состоит из кристалликов льда и кристалликов соли.
Таким образом, раствор замерзает не так, как простая жидкость. Процесс замерзания растягивается на большой температурный интервал.
Если посыпать лёд солью, то лёд начнёт таять. Конечно, это будет иметь место, если температура замерзания насыщенного раствора соли ниже температуры воздуха. При этом лёд будет плавиться, а соль – растворяться
в образовавшейся воде. Процесс плавления требует энергии, которую лёд потребляет из окружающего воздуха. В результате температура воздуха понижается.
Температура кристаллизации раствора соли в воде зависит от
А. концентрации раствора.
Б. химического состава соли.
Правильный ответ
1) только А
2) только Б
3) ни А, ни Б
4) и А, и Б
Конец формы
Начало формы
Что произойдёт с процессом кристаллизации воды в растворе, если не понижать температуру раствора? Ответ поясните.
Конец формы
Начало формы
Температура кристаллизации раствора соли в воде
1) ниже температуры кристаллизации воды
2) равна температуре кристаллизации воды
3) зависит от температуры окружающего воздуха
4) выше температуры кристаллизации воды
Как замерзают растворы2
Если охладить раствор какой-либо соли в воде, то обнаружится, что температура кристаллизации понизилась. Кристаллики появятся в жидкости лишь при температуре на несколько градусов ниже нуля градусов.
Температура кристаллизации зависит от концентрации раствора. Она тем ниже, чем выше концентрация раствора. Например, при растворении 45 кг поваренной соли в 1 м3 воды температура кристаллизации уменьшается до –3 °С. Самую низкую температуру имеет насыщенный раствор, т. е. раствор, содержащий максимально возможное количество растворённой соли. При этом уменьшение температуры достаточно существенное. Так, насыщенный раствор поваренной соли в воде кристаллизуется при температуре –21 °С, а насыщенный раствор хлористого кальция – при температуре –55 °С.
Рассмотрим, как идёт процесс кристаллизации. После того как в растворе появятся первые кристаллики льда, концентрация раствора повысится. Возрастёт относительное число молекул соли, увеличатся помехи процессу кристаллизации воды, и температура кристаллизации понизится. Если дальше не понижать температуру, то кристаллизация остановится. При дальнейшем понижении температуры кристаллики воды продолжат образовываться, и раствор станет насыщенным. Дальнейшее обогащение раствора растворённым веществом (солью) становится невозможным, и раствор застывает сразу. Если рассмотреть замёрзшую смесь в микроскоп, то можно увидеть, что она состоит из кристалликов льда и кристалликов соли.
Таким образом, раствор замерзает не так, как простая жидкость. Процесс замерзания растягивается на большой температурный интервал.
Если посыпать лёд солью, то лёд начнёт таять. Конечно, это будет иметь место, если температура замерзания насыщенного раствора соли ниже температуры воздуха. При этом лёд будет плавиться, а соль – растворяться
в образовавшейся воде. Процесс плавления требует энергии, которую лёд потребляет из окружающего воздуха. В результате температура воздуха понижается.
Температура кристаллизации раствора соли в воде зависит от
А. концентрации раствора.
Б. химического состава соли.
Правильный ответ –
1) только А
2) только Б
3) ни А, ни Б
4) и А, и Б
Конец формы
Начало формы
Температура кристаллизации раствора соли в воде
1) ниже температуры кристаллизации воды
2) равна температуре кристаллизации воды
3) выше температуры кристаллизации воды
4) зависит от температуры окружающего воздуха
Конец формы
Начало формы
Какова масса соли, которую нужно использовать, чтобы двор площадью 100 м2 очистить ото льда, если толщина слоя льда составляет 1 см, а температура окружающего воздуха –3 °С?
1) 40 500 кг
2) 4050 кг
3) 405 кг
4) 40,5 кг
Адсорбция1
Явление смачивания заключается в том, что молекулы жидкости как бы прилипают к твердому телу и более или менее длительно удерживаются на нём. То же может происходить и с молекулами газа. Твердое тело, находящееся в газе, всегда покрыто слоем молекул газа, некоторое время удерживающихся на нём молекулярными силами. Это явление носит название адсорбции.
Количество адсорбированного газа в разных случаях разное. Прежде всего, оно зависит от площади поверхности, на которой могут адсорбироваться молекулы: чем она больше, тем больше адсорбируется газа. Адсорбирующая поверхность особенно велика у пористых веществ, т.е. веществ, пронизанных множеством мелких каналов. Количество адсорбированного газа зависит также от природы газа и от свойств твердого тела.
Одним из примеров веществ, способных адсорбировать громадное количество газа, является активированный уголь, т.е. уголь, освобожденный от смолистых примесей прокаливанием.
Адсорбция на активированном угле и на других твердых телах имеет широкое применение. Она применяется, например, для улавливания ценных газообразных веществ, получающихся при химических реакциях; в медицине – для извлечения вредных газов, образующихся в организме при различных отравлениях, и т.п. Громадное значение имеет адсорбция газов на поверхности твердых тел для ускорения некоторых химических реакций между газами.
Одно из наиболее важных применений адсорбции – улавливание отравляющих газов противогазами. Улавливание осуществляется слоем активированного угля, помещенным внутри респираторной коробки противогаза, соединяющейся при помощи шланга с маской. Кроме угля, в коробке находятся химические поглотители и фильтр для задерживания частиц отравляющих дымов, не задерживаемых углем (см. рисунок). Применение активированного угля для целей противогазовой защиты было предложено Н.Д. Зелинским во время первой мировой войны.

Твердые тела могут адсорбировать не только газы, но и различные растворенные вещества из жидкостей. Это тоже широко используется в технике.
Причиной адсорбции является
А. взаимодействие молекул газа с молекулами твердого тела
Б. действие на молекулы газа силы тяжести
Правильным ответом является
1) только А 2) только Б
3) и А, и Б 4) ни А, ни Б
Конец формы
Начало формы
Какое явление называется адсорбцией?
1) смачивание жидкостью поверхности твердого тела
2) несмачивание жидкостью поверхности твердого тела
3) удержание молекул газа на поверхности твердого тела
4) поглощение молекул газа твердым телом
Конец формы
Начало формы
От чего зависит количество адсорбированного газа?
А. от площади поверхности твердого тела
Б. от природы газа
В. от свойств твердого тела
Правильным ответом является
1) только А
2) только А и Б
3) только А и В
4) А, Б, В
Адсорбция2
Твёрдое тело, находящееся в газе, всегда покрыто слоем молекул газа, некоторое время удерживающихся на нём молекулярными силами. Это явление называется адсорбция. Количество адсорбированного газа зависит от площади поверхности, на которой могут адсорбироваться молекулы. Адсорбирующая поверхность особенно велика у пористых веществ, пронизанных множеством мелких каналов. Количество адсорбированного газа зависит также от природы газа и от химического состава твёрдого тела.
Одним из примеров веществ-адсорбентов является активированный уголь, то есть уголь, освобождённый от смолистых примесей прокаливанием. В промышленности хороший активированный уголь получают из ореховой скорлупы (кокосовой), из косточек некоторых плодовых культур.
Классическим примером использования адсорбирующих свойств активированного угля является противогаз. Фильтры, содержащие активированный уголь, применяются во многих современных устройствах для очистки питьевой воды. Активированный уголь применяется в химической, фармацевтической и пищевой промышленности.
В медицине процесс выведения из организма чужеродных веществ, попадающих в него из окружающей среды или образовавшихся в самом организме токсических продуктов обмена, называется энтеросорбция. Лекарственные средства, поглощающие и выводящие из желудочно-кишечного тракта вредные, токсичные для организма вещества, называют энтеросорбентами. Эффективность энтеросорбентов зависит от площади их активной поверхности. При заданной массе энтеросорбента площадь активной поверхности обратно пропорциональна размеру его частиц: чем меньше размеры частиц, тем больше суммарная площадь их активной поверхности.
Количество адсорбированного газа зависит

1) только от природы газа
2) только от свойств твёрдого тела
3) от природы газа и химического состава твёрдого тела
 4) от природы газа, химического состава твёрдого тела и площади адсорбирующей поверхности
4) от природы газа, химического состава твёрдого тела и площади адсорбирующей поверхности
Конец формы
Начало формы
Какие частицы энтеросорбента (крупные или мелкие) окажут большее терапевтическое действие при одинаковой потребляемой массе сорбента? Ответ поясните.
Конец формы
Начало формы
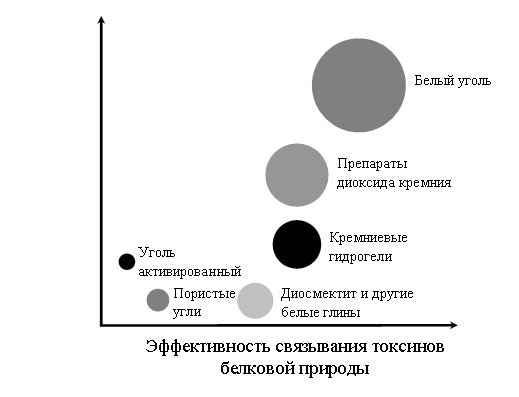
На диаграмме представлены сравнительные характеристики энтеросорбентов на основе диоксида кремния: удобство дозирования и применения (по вертикальной оси) и эффективность применения в расчёте на 1 г сорбента для выведения токсинов белковой природы (по горизонтальной оси). Размер пузырька адсорбированного газа пропорционален площади активной поверхности, приходящейся на 1 г сорбента.
Какое(-ие) из утверждений справедливо(-ы)?
А. При одинаковой массе сорбента наиболее эффективным для связывания токсинов является применение белого угля.
Б. Средством, обладающим максимальным удобством в дозировании и применении, является уголь активированный.
1) только А 2) только Б 3) и А, и Б 4) ни А, ни Б