Изобарный, изохорный, изотермический и адиабатный, политропный.
6. В рамках термодинамики идеальными называются гипотетические (реально не существующие) газы, подчиняющиеся термическому уравнению состояния Клапейрона — Менделеева 
7. Модель Идеальный газ — математическая модель газа, в которой в рамках молекулярно-кинетической теории предполагается, что: 1) потенциальной энергией взаимодействия частиц, составляющих газ, можно пренебречь по сравнению с их кинетической энергией; 2) суммарный объём частиц газа пренебрежимо мал; 3) между частицами нет дальнодействующих сил притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги; 4) время взаимодействия между частицами пренебрежимо мало по сравнению со средним временем между столкновениями.
8. Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. 
9. Моля́рная ма́сса вещества — отношение массы вещества к количеству молей этого вещества, то есть масса одного моля вещества.
Относительной атомной массой химического элемента называется величина, показывающая во сколько раз масса данного атома больше 1/12 массы атома углерода.
Относительной молекулярной массой вещества называется величина, покаывающая во сколько раз масса молекулы больше 1/12 массы атома углерода.
11. Изопроце́ссы — термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление, объём, температура или энтропия — остаются неизменными.
Изопроцессы идеального газа – процессы, при которых один из параметров остаётся неизменным.
Изохорический процесс. Закон Шарля. V = const.
Изохорическим процессом называется процесс, протекающий при постоянном объёме V. Поведение газа при этом изохорическом процессе подчиняется закону Шарля: При постоянном объёме и неизменных значениях массы газа и его молярной массы, отношение давления газа к его абсолютной температуре остаётся постоянным: P/Т = const.
2. Изобарический процесс. Закон Гей-Люссака. Р = const.
Изобарическим процессом называется процесс, протекающий при постоянном давлении Р. Поведение газа при изобарическом процессе подчиняется закону Гей-Люссака: При постоянном давлении и неизменных значениях массы и газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const.
3. Изотермический процесс. Закон Бойля – Мариотта. T = const. Изотермическим процессом называется процесс, протекающий при постоянной температуре Т. Поведение идеального газа при изотермическом процессе подчиняется закону Бойля – Мариотта: При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.
4. Адиабатический процесс (изоэнтропийный): Адиабатический процесс – термодинамический процесс, происходящий без теплообмена с окружающей средой.
12. Объединённый газовый закон, он же Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона — Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
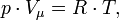
где
 — давление,
— давление,
 — молярный объём,
— молярный объём,
 — абсолютная температура,
— абсолютная температура,
 — универсальная газовая постоянная.
— универсальная газовая постоянная.
13. Уравнение состояния идеального газа (иногда уравнение Менделеева — Клапейрона или уравнение Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. 
14. Сравнивая уравнение состояния идеального газа и основное уравнение кинетической теории газов, записанные для одного моля (для этого число молекул N возьмём равным числу Авогадро NА), найдём среднюю кинетическую энергию одной молекулы:
 и
и  .
.
15. Молярная масса смеси газов: Μ ср=(M1*V1+M1*V2+...+Mn*Vn)/(V1+V2+...+Vn)-при одинаковом давлении.
16.Закон Дальтона для смеси идеальных газов: Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений, т.е.

17. Парциа́льное давление - давление отдельно взятого компонента газовой смеси.
18. Концентрация молекул — физическая величина, равная отношению числа частиц N к объёму V, в котором они находятся:
 .
.
19. Вывод уравнения Клазиуса – неебу.
20. Так, вообще весь 4 отдел не знаю как делать. Такие дела.
Вру. Средняя квадратичная скорость. 
21. Блядь. Тут и в пятом ебошь какая-то. Весь пятый раздел полностью оставил.
22. Распределение энергии Максвелла может быть выражено как дискретное распределение энергии:
 ,
,
где  является числом молекул имеющих энергию
является числом молекул имеющих энергию  при температуре системы
при температуре системы 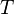 ,
,  является общим числом молекул в системе и
является общим числом молекул в системе и 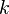 — постоянная Больцмана.
— постоянная Больцмана.
23, Закон Максвелла о распределении по скоростям и энергиям: 
Распределение по вектору импульса: В случае идеального газа, состоящего из невзаимодействующих атомов в основном состоянии, вся энергия находится в форме кинетической энергии. Кинетическая энергия соотносится с импульсом частицы следующим образом: 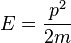
Распределение по энергии
Наконец, используя соотношения  и
и  , мы получаем распределение по кинетической энергии:
, мы получаем распределение по кинетической энергии:

24 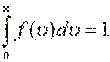 Условие нормировки распределения Максвелла.
Условие нормировки распределения Максвелла.
Уравнение называется условием нормировки функции. Оно определяет вероятность того, что молекула имеет одно из значений скорости от 0 до  . Скорость молекулы имеет какое-нибудь значение: это событие достоверное и его вероятность равна единице.
. Скорость молекулы имеет какое-нибудь значение: это событие достоверное и его вероятность равна единице.
25, Итак, закон Максвелла даёт распределение частиц по значениям кинетической энергии, а закон Больцмана – распределение частиц по значениям потенциальной энергии. Оба распределения можно объединить в единый закон Максвелла – Больцмана:
 . .
|
26, 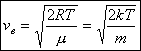 - наиболее вероятная скорость молекул.
- наиболее вероятная скорость молекул.
 - средняя квадратичная скорость молекул.
- средняя квадратичная скорость молекул.
 - средняя арифметическая скорость молекул, где m – масса молекулы.
- средняя арифметическая скорость молекул, где m – масса молекулы.
27, запись скоростей через давление газов -???
28, 1. Опыт Штерна. [1]
Первым экспериментальным подтверждением существования распределения молекул по скоростям можно считать результаты опыта Штерна. Точность этого опыта была недостаточной для установления конкретного вида распределения. Первый прибор для этих целей, состоявший из двух коаксиальных цилиндров.По оси прибора была натянута нагреваемая электрическим током платиновая нить, с поверхности которого испарялись атомы серебра. В условиях созданного внутри прибора вакуума узкий пучок этих атомов, движущихся в радиальном направлении, проходил через продольную щель на поверхности внутреннего цилиндра и оседал в виде узкой вертикальной полоски на поверхности внешнего цилиндра. Если привести весь прибор во вращение, то за время, пока атомы серебра пролетают зазор между цилиндрами, прибор успевает повернуться на некоторый угол и положение следа от пучка на внешнем цилиндре сместится относительно первоначального. Нетрудно установить связь этого смещения с величиной скорости в пучке молекул и угловой скоростью вращения прибора. Исследования профиля следа, который размывается из-за наличия распределения скоростей в пучке, позволило установить качественную картину этого распределения, которое примерно соответствовало максвелловскому. 2. Опыт Элдриджа и Ламмерта
Более точные измерения оказались возможными, когда Элдридж и независимо от него Ламмерт в 1929г сконструировали селекторы скоростей, работающие на принципе зубчатого колеса. В опытах Ламмерта атомы легкоплавкого металла, испаряясь в печи А, выходят наружу через узкую щель. Образовавшийся пучок атомов последовательно пропускается через два вращающихся диска D1 и D2 с радиальными щелями, смещенными относительно друг друга на некоторый угол α (около 2°). За вторым диском помещается еще одна щель, пройдя через которую, пучок попадает на стеклянную пластинку P, охлаждаемую жидким азотом, и конденсируется на ней. Пластинку можно наблюдать с помощью микроскопа M. Поскольку вся система (за исключением, конечно, микроскопа) помещается в вакуум, атома пролетают через нее практически без столкновений. Из числа атомов, пролетевших щель в первом диске, через второй диск пролетят только те, которые подлетят к нему в тот момент, когда на пути пучка встанет прорезь во втором диске. Более быстрые молекулы достигнут диска слишком рано, медленные, наоборот, слишком поздно. Таким образом, это устройство позволяет выделить из пучка атомы, обладающие определенным значением скорости, причем из-за конечной ширины щелей прибор выделяет атомы, скорости которых лежат в пределах некоторого интервала ∆V. Меняя скорость вращения прибора можно выделять из пучка атомы, обладающие различными скоростями. Число этих атомов для каждого интервала скоростей определяется по времени, которое требуется для того, чтобы на пластинке появился осадок, видимый в микроскоп. Результаты опытов Ламмерта и других опытов, проводившихся с той же целью, подтвердили справедливость распределения по скоростям, теоретически установленного Максвеллом.
29, Физи́ческая кине́тика — микроскопическая теория процессов в неравновесных средах.В кинетике методами квантовой или классической статистической физики изучают процессы переноса энергии, импульса, заряда и вещества в различных физических системах (газах, плазме, жидкостях, твёрдых телах) и влияние на них внешних полей.
30, Неравновесное состояние системы, не зависящее от времени, называют стационарным состоянием. В стационарном состоянии, как и в состоянии неполного равновесия, система может характеризоваться значениями макроскопических параметров. [2]
Неравновесное состояние системы характеризуется различными значениями ее параметров в каждой точке системы. [3]
Пусть неравновесное состояние системы описывается средними значениями фурье - компонент Р т эрмитовых динамических переменных Pm (r), обладающих определенной четностью при обращении времени. [4]
31, В неравновесных системах возникают особые необратимые процессы, называемые явлениями переноса, в результате которых происходит пространственный перенос массы, энергии, импульса. Диффузия обусловлена переносом массы, теплопроводность – переносом энергии, а вязкость – переносом импульса.
32, Итак, за 1 секунду, молекула проходит в среднем путь, равный средней арифметической скорости <υ>, и если <z> - среднее число столкновений, испытываемых одной молекулой за 1 с, то среднюю длину свободного пробега можно рассчитать по формуле:

|
Для определения <z> представим себе молекулу в виде шарика диаметром d, который движется среди других «застывших» молекул. Эта молекула столкнется только с теми молекулами, центры которых находятся на расстояниях, равных или меньших d, т.е. лежащих внутри «ломаного» цилиндра радиусом d
Эффективный диаметр - Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром – d (Рис.46.1).

Средняя длина свободного пробега молекул будет равна: 
33, Диффу́зия — процесс взаимного проникновения молекул или атомов одного вещества между молекулами или атомами другого, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объёму
34, Уравнение Фика в интегральной форме – либо не существует, либо нужно интегрировать дифф. форму которую я так же не нашёл. Просто закон диффузии –
j(m)=-D(dp/dx).
35, Коэффицие́нт диффу́зии — количественная характеристика скорости диффузии, равная количеству вещества (в массовых единицах), проходящего в единицу времени через участок единичной площади (например, 1 м²) при градиенте концентрации, равном единице (соответствующем изменению 1 моль/л → 0 моль/л на единицу длины).
36. Вя́зкость (вну́треннее тре́ние) — одно из явлений переноса, свойство текучих тел (жидкостей и газов) оказывать сопротивление перемещению одной их части относительно другой.
37, Уравнение Ньютона в интегральной форме – Если найдёте – буду рад.
Динамическая вязкость
Внутреннее трение жидкостей, как и газов, возникает при движении жидкости вследствие переноса импульса в направлении, перпендикулярном к направлению движения. Справедлив общий закон внутреннего трения — закон Ньютона:

Коэффициент вязкости  (коэффициент динамической вязкости, динамическая вязкость) может быть получен на основе соображений о движениях молекул. Очевидно, что
(коэффициент динамической вязкости, динамическая вязкость) может быть получен на основе соображений о движениях молекул. Очевидно, что  будет тем меньше, чем меньше время t «оседлости» молекул. Эти соображения приводят к выражению для коэффициента вязкости, называемому уравнением Френкеля-Андраде:
будет тем меньше, чем меньше время t «оседлости» молекул. Эти соображения приводят к выражению для коэффициента вязкости, называемому уравнением Френкеля-Андраде:

39, Теплопрово́дность — способность материальных тел к переносу энергии (теплообмену) от более нагретых частей тела к менее нагретым частям тела, осуществляемому хаотически движущимися частицами тела (атомами, молекулами, электронами и т. п.). Такой теплообмен может происходить в любых телах с неоднородным распределением температур, но механизм переноса теплоты будет зависеть от агрегатного состояния вещества.
40, Уравнение Фурье в интегральной форме - В интегральной форме это же выражение запишется так (если речь идёт о стационарном потоке тепла от одной грани параллелепипеда к другой):

где  — полная мощность тепловых потерь,
— полная мощность тепловых потерь,  — площадь сечения параллелепипеда,
— площадь сечения параллелепипеда,  — перепад температур граней,
— перепад температур граней,  — длина параллелепипеда, то есть расстояние между гранями.
— длина параллелепипеда, то есть расстояние между гранями.