КУРСОВАЯ РАБОТА
Дисциплина: ОРГАНИЧЕСКАЯ ХИМИЯ
Тема: СИНТЕЗ, ОЧИСТКА И АНАЛИЗ 2-НАФТИЛАЦЕТАТА
СОДЕРЖАНИЕ
Реферат
Условные обозначения, названия и единицы измерения физических величин
Введение
Свойства 2-нафтилацетата и исходных веществ
Физические свойства 2-нафтилацетата
Электронное строение
1.3 Способы получения
Свойства исходных веществ
2 Расчет количеств исходных веществ
Расчет количеств исходных веществ по методике
2.3 Расчет количеств исходных веществ по уравнению
3 Главные этапы синтеза
Приготовление исходных и вспомогательных реактивов и собирание приборов
Приготовление исходных и вспомогательных реактивов
Сборка приборов
Отделение вещества от сопутствующих продуктов
3.3 Идентификация
4 Ход синтеза
5 Характеристика синтезированного вещества
5.1 Физико-химические константы и растворимость
Идентификация
Выход продукта
Выводы и рекомендации
Список использованных источников
Приложения
УСЛОВНЫЕ ОБОЗНАЧЕНИЯ, НАЗВАНИЯ И ЕДИНИЦЫИЗМЕРЕНИЯ ФИЗИЧЕСКИХ ВЕЛИЧИН
Абсолютная погрешностьδ, %
Относительная погрешность∆
Выход вещества от теоретическогоηт, %
Выход вещества от указанного в методикеηм,%
Индукционный эффектI
Мезомерный эффектM
Количество вещества ν, моль
Избыток количества веществаνизб,моль
Теоретическое количество вещества по уравнениюνт, моль
Избыток количества вещества в % ν(%), %
Масса веществаm, г
Масса раствораmр-ра, г
Теоретическая масса веществаmт, г
Масса вещества по методикеmм, г
Масса полученного веществаmр, г
Молярная масса вещества М, г/моль
Массовая доляω, %
Объем раствораV или Vр-ра,мл
Показатель преломленияn20D
Плотность веществаρ, г/см3 Плотность раствораρр-ра, г/мл
Температура кипенияt, ⁰С
Температура плавленияt, ⁰C
Теоретическое значение температуры плавленияt1, ⁰C
Экспериментальное значение температуры плавленияt2, ⁰C
ВВЕДЕНИЕ
нафтилацетат реактив синтезированный
Целью курсовой работы является синтез 2-нафтилацетата по выбранной методике. Рассчитать исходные количества вещества по методике и по уравнению реакции, выход продукта. Анализ экспериментальных данных: выход продукта реакции, физико-химические константы (определение температуры плавления, проверка растворимости), идентификация. Рассмотреть различные способы получения, строение, химические свойства данного вещества.
Для полученного 2-нафтилацета необходимо провести очистку от сопутствующих веществ и проделать качественные реакции, исследовать растворимость в различных растворителях, определить температуру плавления. Проанализировать экспериментальные данные и сделать выводы по выходу продукта, степени чистоты полученного вещества. Сделать вывод о целесообразности использования данной методики для синтеза 2-нафтилацетата.
-Нафтилацетат - органическое соединение, относится к классу сложных эфиров и имеет формулу:
Структурная формула: Молекулярная формула:
С12Н10О2
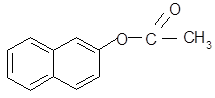
Название по систематической номенклатуре:уксуснонафталиновый эфир.
По рациональной: 2-нафтилацетат.
1 СВОЙСТВА 2-НАФТИЛАЦЕТАТА И ИСХОДНЫХ ВЕЩЕСТВ
Физические свойства 2-нафтилацетата
-Нафтилацетат - бесцветное кристаллическое вещество, кристаллизуется из этанола в виде игл, растворим в этаноле, эфире, хлороформе, нерастворим в воде. Молекулярная масса 186,21 г/моль, температура плавления 68,5⁰С.[3] Сведений о токсичности 2-нафтилацетата не имеется, но данное вещество может быть получено из нафталина, воздействие которогочрезвычайно опасно для здоровья человека, а иногда даже смертельно[5].
Электронное строение
Молекула 2-нафтилацетата состоит из двух конденсированных бензольных колец (нафталина) и кислотного остатка уксусной кислоты - иона. Рассмотрим сначала строение нафталина. Молекула нафталина состоит из двух конденсированных колец в о-положенияхбензольных колец. В нафталине все десять атомов С находятся sp2 - гибридизации. Не гибридизованные р-орбитали образуют сопряженную систему, состоящую из десяти π-электронов. Согласно современным представлениям молекула нафталина имеет плоское строение с менее равномерным, чем в бензоле, распределением π-электронной плотности, что проявляется в различной длине связей С - С:
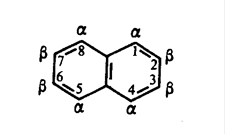
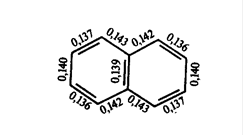
Положения 1,4,5, и 8 принято называть α-положениями, а 2,3,6 и 7 - β-положениями. Для нафталина, таким образом возможно существованиедвух однозамещенных изомеров: α- и β-изомеров [1].
Ацетат-ион 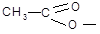 , входящий в состав 2-нафтилацетата, находится в положении 2 (β), он относится к ориентантам второго рода, и за счет отрицательных мезомерного (- М)и индукционного эффекта (- I) снижает электронную плотность в положениях 1, 3, 6, 8, так как α-положение второго кольца обладает большей активностью по сравнению с β-положениями, то замещение происходит в положениях 5 и 8.
, входящий в состав 2-нафтилацетата, находится в положении 2 (β), он относится к ориентантам второго рода, и за счет отрицательных мезомерного (- М)и индукционного эффекта (- I) снижает электронную плотность в положениях 1, 3, 6, 8, так как α-положение второго кольца обладает большей активностью по сравнению с β-положениями, то замещение происходит в положениях 5 и 8.
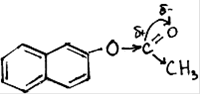
Характерные реакции:
реакции электрофильного замещение SE,
реакции нуклеофильного замещения по связи  ,
,
реакции окисления.
· Реакции нуклеофильного замещения
Для 2-нафтилацетата характерны реакции гидролиза (а), переэтерификации (б), образования амидов (в). Реакция катализируется кислотами и основаниями, протекает при обычной температуре.
(а)
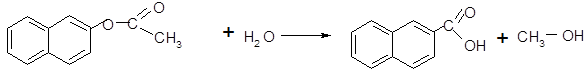
2-нафтилацетат нафталиновая кислота
В результате реакции гидролиза образуется нафталиновая кислота и этиловый спирт [1].
(б)
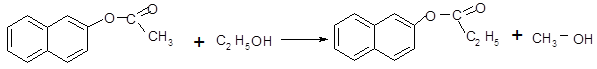
2-нафтилацетат этанол2-нафтилпропанат метанол
При взаимодействии со спиртами возможна замена радикала у гидроксильного кислорода, таким образом может образоваться другой эфир, в данном случае образовался 2-нафтилпропанат.
· Реакции электрофильного замещения
(в)
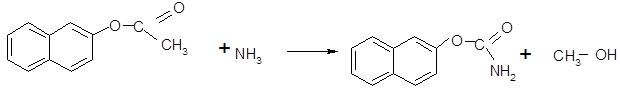
2-нафтилацетатаммиак 2-нафтилацетатамидметанол
Способы получения
-Нафтилацетат можно получить из органических веществ различных классов несколькими способами: реакцией этерификации, ацилирования спиртовгалогенарилами, ангидридами карбоновых кислот и реакцией ацилирования в щелочной среде из солей карбоновых кислот.
· Реакция этерификации
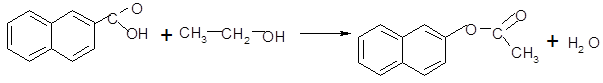
нафталиновая кислота этиловый спирт 2-нафтилацетат [1]
Реакция проходит в присутствии минеральных кислот.
· Реакция ацилированиягалогенангидрида. Эта реакция идет в присутствии катализатора BF3.
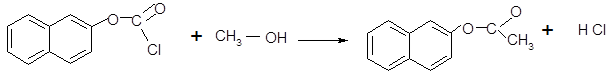
хлор-2-нафтилат2-нафтилацетат[2]
· Реакция ацилирования в щелочной среде:

2-нафтилацетатацетат натрия [3]
Побочные реакции:
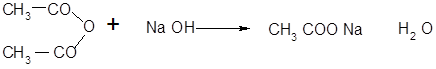
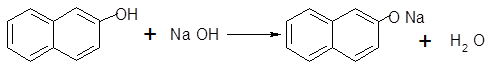
-нафтолгидроксид натриянафтолят натрия
Реакция этерификации обратима, чтобы увеличить выход вещества необходимо постоянное выведение эфира или воды из сферы реакции. Ацилированиегалогенангидридами идет в присутствии дорогостоящего катализатора фторида бора.
Для получения 2-нафтилацетата в данном синтезе выбрана реакция ацилирования в щелочной среде[3], так как эта реакция не требует жестких условий проведения, протекает быстро и выход продукта реакции достаточно велик.
Свойства исходных веществ
-Нафтол представляет собой полупрозрачные белые пластинки с фенольным запахом.
Уксусный ангидрид - бесцветная с резким запахом жидкость.
Гидроксид натрия - твердое кристаллическое вещество белого цвета.
Остальные свойства исходных веществ и их физические константы представлены в таблице 1.
Таблица 1 - Свойства 2-нафтилацетата и исходных веществ
| Название вещества, формула | М, г/моль | tкип. ºC | tпл. ºC | nD20 | ω,% | ρ, г/см3 | Растворимость | Примечание |
| 2-нафтилацетат C12H10O2 | 186,21 | -- | 68,5 | -- | -- | -- | Растворим в этаноле, эфире, хлороформе,нерастворим в воде. [4] | Нет данных об отрицательном воздействии на человека. |
| Уксусный ангидрид С4Н6О3 | 102,09 | 139,5 | -73,1 | 1.3904 | -- | 1,082 | В бензоле, эфире и др. органичсеких растворителях. С водой образует уксусную кислоту.[5] | Раздражает глаза и дыхательные пути, вызывает ожоги кожи |
| Гидроксид натрия NaOH | 39,997 | - | 2,02 | в воде-52,2 (20 °С), метаноле-23,6 (28 oС), этаноле-14,7 (28 °С) [6] | Щелочь при попадании на кожу и слизистые оболочки вызывает сильные ожоги | |||
| 2-нафтол С10Н7ОН | 285 - 286 | 121,6 | -- | -- | -- | В этаноле, диэтиловом эфире, хлороформе, бензоле, плохо растворим в воде.[4] | Горюче,НЕ ДОПУСКАТЬ открытого огня.порошком, разбрызгиванием воды, пеной, двуокисью углерода, взрывоопасно, при вдыхании появляются Мелкодисперсные частицы в воздухе образуют взрывоопасныe смеси. Не допускать накопления пыли; закрытая система, защищенное от взрыва при накоплении пыли электрооборудование и освещение. НЕ ДОПУСКАТЬ РАССЕИВАНИЯ ПЫЛИ! Вдыхание Кашель.боли в горле, под воздействием 2-нафтола на коже появляется покраснение. Защита органов дыхПокраснение. Боль. Защитные перчатки. Защитная одежда. Ополоснуть и затем промыть кожу водой с мылом. Боль в глазах.При проглатывании вызывает рвоту, боли в желудке, судороги.Боль в животе. Судороги. Понос. Рвота. Не принимать пищу, не пить и не курить во время работы. Прополоскать рот. Дать выпить большое количество воды. |
РАСЧЕТ КОЛИЧЕСТВ ИСХОДНЫХ ВЕЩЕСТВ
Все данные, необходимые для дальнейших расчетов берутся из таблицы 2.
Расчет количеств исходных веществ по методике
Исходные вещества для получения 2-нафтилацетата берутся в следующих количествах:
2-нафтол, 10 г
Уксусный ангидрид, 10,5 мл, ρ=1,082 г/мл
Гидроксид натрия, 50 мл, ω=10%, ρ=1,11 г/см3
· Рассчитываем массу уксусного ангидрида по формуле:
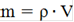
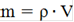 ,(1)
,(1)
где m-масса вещества,г
ρ - плотность вещества,г/см3
V - объем вещества, мл
m=1,082∙10,5=11,36 г
Количество вещества ν, мольвычисляют по формуле:
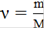
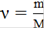 , (2)
, (2)
где ν - количество вещества, моль
ν(С4Н6О3)=11,36/102,09=0,11 моль
· Рассчитываем массу гидроксида натрия, содержащегося в 50 мл раствора, ω=10%, ρ=1,11 г/см3
Находим массу раствора гидроксида натрия по формуле:
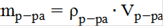
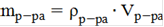 , (3)
, (3)
где mр-ра - масса раствора, г
ρр-ра- плотность раствора,г/мл
Vр-ра - объем раствора, мл
mр-ра=1.11∙50=55.50г
Массу самого вещества находим из формулы:
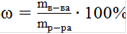
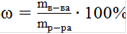 , (4)
, (4)
где ω - массовая доля, %
mв-ва - масса растворенного вещества, г
m(NaOH)=55,5∙0,1=5,55 г
Рассчитываем количество вещества гидроксида натрия из формулы (2):
ν(NaOH)=5,55/40=0,14 моль
· Рассчитываем количество вещества 2-нафтола
По формуле (2):
ν(С10Н7ОН)=10/144=0,07 моль
2.2 Расчет количеств исходных веществ по уравнению
Из уравнения реакций [3] видно,что ν(С10Н7ОН):ν(С4Н6О3):ν(NaOH)=1:1:1, следовательно, 2-нафтолвзят в недостатке. Считаем по недостатку.
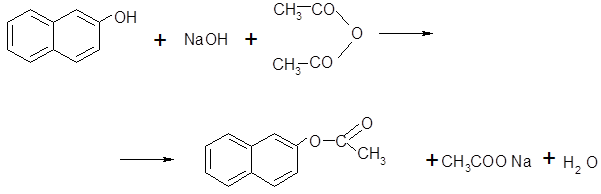
ν(С10Н7ОН)=ν(С4Н6О3)=ν(NaOH)=0,07 моль
· Рассчитываем избыток гидроксида натрия в молях и в % соответственно по формулам:

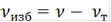 , (5)
, (5)
где νизб - избыток количества вещества, моль
νт - теоретическое количество вещества по уравнению.
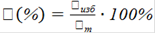

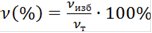 , (6)
, (6)
гдеν(%) - избыток количества вещества в %.
νизб(С4Н6О3)=0,11 - 0,07=0,04 моль
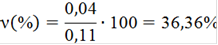
νизб(NaOH)=0,14-0,07=0,07 моль
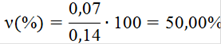
· Рассчитываем массы исходных веществ по уравнению
Из формулы (2) находим массу в 100% вещества:
m(С10Н7ОН)=0,07∙144=10,08 г
m(С4Н6О3)=0.07∙102.09=7,15 г
m(NaOH)=0,07∙40=2,8 г
Из формул (2) и (4) рассчитываем массы и объемы веществ данной концентрации:
m(С4Н6О3)=7.15 г
V(С4Н6О3)=7,15∙1,082=7,74 мл
mр-ра(NaOH)=2.8/0.1=28 г
Vр-ра=28/1,11=25,23 мл
Все расчеты сведены в таблице 2.
Таблица 2 - Количества исходных веществ
| Название вещества, формула | Требуемые количества | избыток | ||||||
| По уравнению | По методике | νизб, моль | В % | |||||
| νт | в г и мл | νм | В г и мл | |||||
| 100% вещества | Данной концентрации | 100% вещества | Данной концентрации | |||||
| 2-нафтол С10Н7ОН | 0,07 | 10,08 г | 10,08 г | 0,07 | 10,08г | 10,08г | -- | -- |
| Уксусный ангидрид С4Н6О3 | 0,07 | 7,15 г | 7,15 г 7,74 мл | 0,11 | 11,36 г 10,50 мл | 11,36г 10,50 мл | 0,04 | 36,36 |
| Гидроксид натрия NaOH, ω=10% | 0,07 | 2,8 г | 28 г 25,23 мл | 0,14 | 5,55 г | 55,5 г 50 мл | 0,07 | 50,00 |
Реакция ацилированияβ-нафтола уксусным ангидридом протекает в разбавленном растворе щелочи, уксусный ангидирд берется в избытке, для того, чтобы сместить равновесие реакции в сторону образования эфира, тем самым увеличивая выход продукта. Гидроксида натрия и уксусного ангидрида по уравнению реакции требуется 0,07 моль, а по методике 0,118 и 0,04 моль соответственно.
3 ГЛАВНЫЕ ЭТАПЫСИНТЕЗА
Приготовление исходных и вспомогательных реактивов и собирание приборов
Приготовление исходных и вспомогательных реактивов
· Прежде чем использовать 2-нафтол в синтезе, его перекристаллизовывают из воды, разбавленного этилового спирта или четыреххлористого углерода. В качестве растворителя удобно использовать воду, в этом случае перекристаллизацию проводят так: круглодонную колбу с навеской 2-нафтола помещают на песчаную баню, добавляют небольшое количество воды (в несколько меньшем количестве, чем требуется для полного растворения) и нагревают колбу. После полного растворения 2-нафтола горячий раствор выливают в плоскодонную колбу или химический стакан через воронку со смоченным бумажным фильтром приспособление для перекристаллизация приведено на рисункеА1 в приложении А. В процессе охлаждения отфильтрованного раствора образуются кристаллы 2-нафтола, которые потом отделяют от воды вакуум-насосом на воронке Бюхнера (рисунок А2 приложения А).
· В круглодонную колбу на 500 мл наливают 50 мл 10% раствор гидроксида натрия, помещают туда 10 г 2-нафтола, взвешенного на технических весах. Аккуратно перемешивая содержимое колбы, растворяют большую часть 2-нафтола.
· Добавляют 10,5 мл уксусного ангидрида и колотый лед. Снова встряхивают колбу для большего растворения 2-нафтола.
· Приготовление раствора гидроксида натрия, ω=10%, 50 мл.
Взвешиваем рассчитанную массу гидроксида натрия (стр. 12).
Рассчитываем объем воды, требующийся для 50 мл раствора:
m(H2O)=mр-ра - m(NaOH)=55.5 - 5.55=50 г
ρ(H2O)=1 г/мл
V(H2O)=50∙1.00=50 мл
Навеску, взвешенную на технических электронных весах, помещают в химический стакан, добавляют 50 мл воды и перемешивают стеклянной палочкой до полного растворения.
Сборка приборов
Круглодонную колбу со смесью соединяем с обратным воздушным холодильником. Перемешивают смесь в течении 15 - 20 минут, круговыми движениями колбы, придерживая холодильник (рисунок 1).
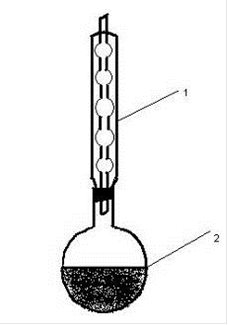
Рисунок 1 - Прибор для синтеза 2-нафтилацетата. 1 - обратный холодильник, 2 - круглодонная колба.
Отделение вещества от сопутствующих продуктов
· Полученные кристаллы 2-нафтилацетата отфильтровывают на воронке Бюхнера.
· Кристаллы 2-нафтилацетата промывают на воронке водой, сушат на воздухе.
· Очищают высушенный продукт перекристаллизацией из разбавленного этилового спирта или из бензина с температурой кипения 60 - 80°С, так как 2-нафтилацетат растворим в этих веществах. Процесс перекристаллизации можно проводить в химическом стакане. Для этого в разбавленный этиловый спирт помещают 2-нафтилацетат и перемешивают стекляннойпалочой до растворения вещества. Очищаемое вещество переходит в раствор, а нерастворимые примеси будут оседать на дне стакана. Отделяют верхний слой, аккуратно сливая его в химический стакан.
· Полученный очищенный 2-нафтилацетат отсасывают на воронке Бюхнера и сушат.
· При необходимости повторяют очистку.
· Выход 2-нафтилацетата по методике составляет 13 г.
Идентификация
Для идентификации полученного вещества проводят качественную реакцию, проверяют растворимость в растворителях, определяют температуру плавления.
ХОД СИНТЕЗА
В качестве исходного вещества по методике используют перекристаллизованный 2-нафтол, но для синтеза брали обычный реактив, то есть перекристаллизацию не проводили. Сначала смешивали 2-нафтол и 10%-ный раствор гидроксид натрия. Смесь этих веществ в колбе приобрела бежевый оттенок, произошло частичное растворение пластинок 2-нафтола. Затем добавили колотый лед. В последнюю очередь добавляли уксусный ангидрид. Колбу соединили с воздушным обратным холодильником. Перемешиваем смесь, встряхивая колбу. В процессе реакциинаблюдается выпадение белых кристаллических пластинок 2-нафтилацетата. Через 15 минут содержимое колбы отфильтровали на воронке Бюхнера (рисунок 2) и промыли водой. Полученное вещество высушили на воздухе. Высушенный 2-нафтилацетат представлял собой темно-бежевое кристаллическое вещество, имеющее слабый фенольный запах.
Произвели очистку вещества из разбавленного этанола, при этом изменился цвет вещества - от темно-бежевого до светло-бежевого. Продолжительность синтеза составила около 1,5 часа, не учитывая время высушивания вещества.
Выход 2-нафтилацетата составил 6.3 г.
5 ХАРАКТЕРИСТИКА СИНТЕЗИРОВАННОГО ВЕЩЕСТВА
Синтезированный 2-нафтилацетат представляет собой кристаллическое вещество светло-бежевого цвета, имеющие вкрапления бесцветных кристаллов, со слабым фенольным запахом. Для характеристики данного вещества следует установить его температуру плавления, провести идентификацию и проверить растворимость в различных растворителях.
5.1 Физико-химические константы и растворимость
Для определения температуры плавления использовался прибор, изображенный на рисунке 3А приложения А. В стеклянный капилляр плотно набиваем 2 - 3 мм полученного 2-нафтилацетата, капилляр присоединяем резиновым кольцом к термометру и помещаем в прибор для определения температуры плавления. В процессе нагревания столбик уплотняется, появляются пузырьки воздуха, в момент появления которых отмечаем температуру на термометре. Была установлена температура плавления равная 68,5 °С. Теоретическое значение составляет 71°С. Рассчитываем абсолютную погрешность:
t1 - теоретическое значение температуры плавления,
t2 - значение, определенное экспериментально.
Δ=|t1 - t2|=|71 - 68.5|=2.5
Рассчитываем относительную погрешность:
δ=Δ/t1∙100%=2.5/71∙100=3.52%
Достаточно высокую погрешность можно объяснить присутствием примесей, которые трудно отделить обычной перекристаллизацией.
Проверили растворимость 2-нафтилацетата в четырех разных растворителях: воде, ацетоне, диэтиловом эфире и этаноле. В четыре пробирки поместили небольшое количество вещества и добавили растворители. Полное растворение было отмечено в эфире, ацетоне, этаноле. Растворения в горячей и холодной воде не произошло.
Идентификация
Для определения 2-нафтилацетата нужно провести качественную реакцию. Уравнения реакции:
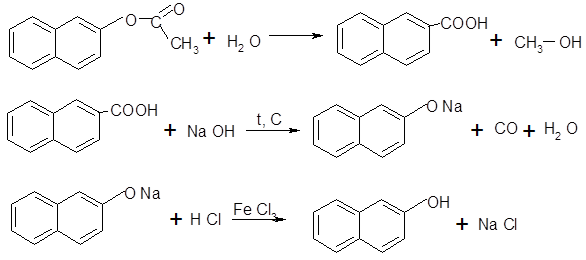
В пробирку вносим небольшое количество полученного вещества, добавляем 3 мл воды, немного раствора щелочи и кипятим жидкость 1 - 2 минуты. Затем раствор охлаждаем, добавляем соляной кислоты и несколько капель раствора хлорида железа (III). Появляется зеленоватая окраска (реакция на 2-нафтол).
Выход продукта
Вычислим теоретический выход. Как уже было сказано ранее, 2-нафтол взят в недостатке, в количестве 0,07 моль, следовательно ν(2-нафтилацетат) = 0,07 моль.
Рассчитываем теоретический выход 2-нафтилацетата, используя формулу 3:
mт(С6Н5NH2) = 0,07∙186,21 =13,03 г.
Выход вещества от теоретического (по уравнению)ηт,%:

 ,(3)
,(3)
где mp - масса полученного вещества,
mТ - теоретическая масса вещества.
ηт=6,3/13,03∙100=48,35 %
Выход вещества от указанного в методикеηм:

 ,(4)
,(4)
гдеmp - масса полученного вещества,
mМ -масса вещества, указанная в методике.
ηм=6,3/13∙100=48,46%
Все данные, полученные в ходе работы сводим в таблицу 4.
Таблица 3 - Выход и физико-химические константы
| Название вещества, формула | Константа вещества | Выход вещества | ||||
| mp,г | % | |||||
| Установленная в работе | По литературным данным | От теоретического, ηт | От указанного в методике, ηм | |||
| 2-нафтилацетат C12H10O2 | tпл, °С | 68,5 | 6,3 | 48,35 | 48,46 |
6 ВЫВОДЫИ РЕКОМЕНДАЦИИ
· В ходе синтеза был получен 2-нафтилацетат, представляющий собой кристаллическое вещество темно бежевого цвета. Была проведена очистка вещества. Качественная реакция дала положительный эффект. Также для 2-нафтилацетата определена экспериментальным путем температура плавления, которая отличается от теоретического показателя на 3,52%. При исследовании вещества на растворимость в воде, ацетоне, эфире и этаноле, полученные результаты совпадают со справочными, 2-нафтилацетат растворился в диэтиловом эфире, ацетоне и этаноле.
· Выход продукта равен 6,3 г, что составляет 48,35 и 48,36% от выхода по уравнению реакции и от выхода по методике соответственно. Причины небольшого выхода продукта: потери при проведении синтеза, в процессе очистки часть вещества удалялась вместе с примесями, по методике исходный 2-нафтол следует подвергать очистке методом перекристаллизации, но в данном синтезе использовался неперекристаллизованный реактив, что могло помешать большему образованию 2-нафтилацетата. Чтобы увеличить выход продукта следует проводить очистку исходного 2-нафтола.
· Так как вещество получилось более темного цвета, чем описано в методике, а температура плавления отличается оттеоретической на 3,5%, можно предположить, что в нем еще осталось некоторое количество примесей.
· Данная методика получения 2-нрафтилацетата вполне приемлема для проведения синтеза в лабораторных условиях, так как не требует особенных условий реакции и протекает достаточно быстро. Выбранный синтез 2-нафтилацетата практически безвреден для экологии, но может оказывать вредное воздействие на человека в силу токсичности 2-нафтола, уксусного ангидрида и гидроксида натрия.
· Полученное вещество применяется в парфюмерии, в качестве отдушек в мыловарении.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1. Артеменко А.И. Органическая химия: Учеб.для строит. спец. вузов - 5-е изд., испр. - М.: Высш. Шк., 2002. - 559 с.: ил.
. Ким А.М. Органическая химия: учеб.пособие. - 2-е изд., испр. и доп. - Новосибирск: Сиб. унив. Изд-во, 2001. - 814 с.
. Практикум по органическому синтезу. Учеб.пособие для студентов пед. ин-тов.М., «Просвещение», 1974, 240 стр.
. Храмкина М.Н. Практикум по органическому синтезу. Изд. 3-е, испр., Л., «Химия», 1974, 320 стр.
5. Интернет энциклопедия «Википедия»:<https://ru.wikipedia.org>
. Интернет справочник по химическим веществам: iprit.ru
ПРИЛОЖЕНИЕ А
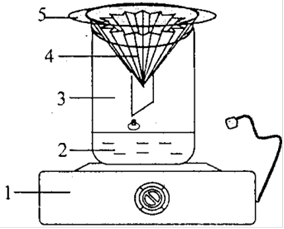
Рисунок А1 - Приспособление для горячего фильтрования (перекристаллизации): 1 - электроплитка, 2 - растворитель, 3 - химический стакан, 4 - воронка с фильтром, 5 часовое стекло
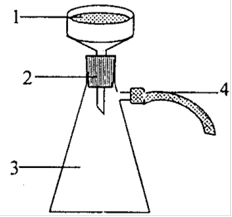
Рисунок А2 - Установка для фильтрования под вакуумом: 1 - воронка Бюхнера с бумажным фильтром, 2 - резиновая пробка, 3 - колба Бунзена, 4 -резиновая трубка к вакуум-насосу
Рисунок 3 - Прибор для определения температуры плавления: а - термометр с капилляром помещенный в пробирку, б - крепление на термометре капилляра с веществом.