Занятие 4
БИОХИМИЯ МЫШЕЧНОЙ ТКАНИ
Мышечная ткань составляет 40% от веса тела животного. Биохимические процессы, протекающие в мышцах, оказывают большое влияние на весь организм.
ФУНКЦИЯ МЫШЦ - МЕХАНИЧЕСКОЕ ДВИЖЕНИЕ, в котором химическая энергия превращается в механическую при постоянном давлении и постоянной температуре.
ПОПЕРЕЧНО-ПОЛОСАТАЯ МУСКУЛАТУРА Функциональная единица - САРКОМЕР.
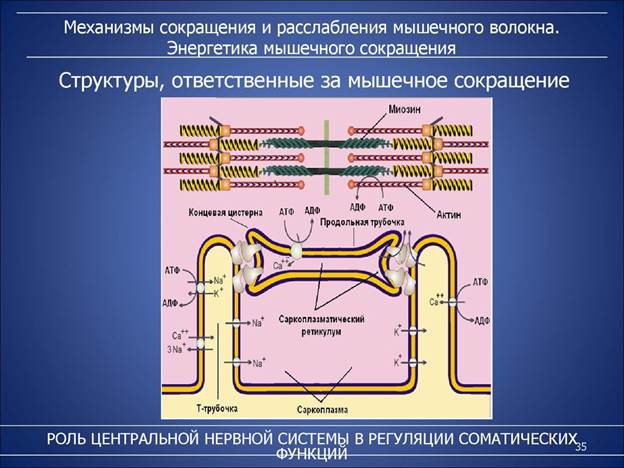
ТОЛСТАЯ НИТЬ -Состоит из молекул белка миозина.
Свойства миозина. 1. В физиологических условиях (оптимальные pH, температура, концентрации солей) молекулы миозина спонтанно взаимодействуют между собой своими стержневыми участками ("конец в конец", "бок в бок") с помощью слабых типов связей. Взаимодействуют только стержни, головки остаются свободными.2. Молекула миозина обладает ферментативной активностью (АТФ-азная активность: АТФ+Н2О----->АДФ+Ф). Активные центры расположены на головках миозина.Примечание: чистый миозин in vitro обладает АТФ-азной активностью, но она очень низка.
3. Миозин своими головками способен взаимодействовать с актином (актин- сократительный белок), входящим в состав тонких нитей.
Присоединение актина к миозину мгновенно увеличивает АТФ-азную активность миозина (больше, чем в 200 раз). Актин является аллостерическим активатором миозина.
ТОНКИЕ НИТИ В состав тонких нитей входят три белка:- сократительный белок актин
- регуляторный белок тропомиозин- регуляторный белок тропонин
МЕХАНИЗМ МЫШЕЧНОГО СОКРАЩЕНИЯ.
1-я стадия. Фиксация АТФ на головке миозина.
2-я стадия. Гидролиз АТФ. Продукты гидролиза (АДФ и Ф) остаются фиксированными, а выделившаяся энергия аккумулируется в головке. Мышца готова к сокращению.
3-я стадия. Образование комплекса “актин-миозин”. Он очень прочен. Может быть разрушен только при сорбции новой молекулы АТФ.
4-я стадия Конформационные изменения молекулы миозина, в результате которых происходит поворот головки миозина. Освобождение продуктов реакции (АДФ и Ф) из активного центра головки миозина.
Головки миозина ”работают” циклично, как плавники у рыбы или как весла у лодки, поэтому этот процесс называется “вёсельным механизмом” мышечного сокращения.
РЕГУЛЯЦИЯ МЫШЕЧНОГО СОКРАЩЕНИЯ
ТРОПОМИОЗИН.Молекула тропомиозина закрывает активные центры связывания актина на поверхности глобул актина.
ТРОПОНИН.Глобулярный белок,Располагается на тропомиозине с равными промежутками, длина которых равна длине молекулы тропомиозина.Тропонин Т (ТнТ) - отвечает за связывание тропонина с тропомиозином, через тропонин "Т" конформационные изменения тропонина передаются на тропомиозин.Тропонин С (ТнС) - Ca2+-связывающая субъединица, содержит 4 участка для связывания кальция, по строению похожа на белок кальмодулин. Тропонин I (ТнI) - ингибиторная субъединица - это ненастоящий ингибитор - он тоько лишь создает пространственное препятствие, мешающее взаимодействию актина и миозина в момент, когда тропонин "С" не связан с Са2+.
РЕГУЛЯЦИЯ СОКРАЩЕНИЯ И РАССЛАБЛЕНИЯ МЫШЦ В ЖИВОЙ КЛЕТКЕ
СОКРАЩЕНИЕ
1. Мышечное сокращение начинается с нервного импульса. Под воздействием ацетилхолина развивается возбуждение клеточной мембраны и резко повышается ее проницаемость для Са2+.
2. Са2+ поступает в цитоплазму мышечной клетки (саркоплазма) из депо - цистерн цитоплазматического ретикулума. Концентрация Са2+ в саркоплазме мгновенно увеличивается в 100 раз (с 10-7М до 10-5М).
3. Кальций связывается с тропонином "С". Это приводит к конформационным изменениям молекулы тропонина, в результате устраняется пространственное препятствие в виде тропонина "I", в результате конформационных изменений тропонина "Т" молекула тропомиозина оттягивается в сторону и открывает на поверхности актина миозин-связывающие центры.
РАССЛАБЛЕНИЕ
Чтобы произошло расслабление мышцы, необходимы следующие условия:
1. Освобождение тропонина "С" от Са2+ - для этого работает мембрано-связанный фермент Са2+-зависимая АТФаза. Этот фермент использует энергию гидролиза АТФ для переноса Са2+ обратно в цистерны против градиента их концентраций. Не только процесс сокращения, но и процесс расслабления нуждается в АТФ, потому что если нет АТФ, то не работает Са2+-зависимая АТФаза. В этих условиях кальций связан с тропонином "С" - вся система находится в активном состоянии, нет распада актомиозинового комплекса - мышца постоянно находится в состоянии сокращения. Такая ситуация наблюдается после смерти животного в состоянии "трупного окоченения".
Запасы АТФ в клетке значительны, но их хватает для обеспечения мышечной работы только в течение 0.1 секунды. Но в мышечной клетке идет очень быстрый ресинтез АТФ.
МЕХАНИЗМЫЭНЕРГООБЕСПЕЧЕНИЯ МЫШЕЧНОЙ РАБОТЫ
ИСТОЧНИКИ ЭНЕРГИИ:
1) Креатинфосфокиназная реакция.
Это самый быстрый способ ресинтеза АТФ. Запасов креатинфосфата хватает для обеспечения мышечной работы в течение 20 секунд.
Максимально эффективен. Не требует присутствия кислорода, не дает побочных нежелательных продуктов, включается мгновенно. Его недостаток - малый резерв субстрата (хватает только на 20 секунд работы).
2. Гликолиз, гликогенолиз.
Не требуют присутствия кислорода (анаэробные процессы). Обладают большим резервом субстратов. Используется гликоген мышц (2% от веса мышцы) и глюкоза крови, полученная из гликогена печени.
Недостатки:
1) Небольшая эффективность: 2 АТФ на один глюкозный остаток гликогена.
2) Накопление недоокисленных продуктов (лактат).
3) Гликолиз начинается не сразу - только через 10-15 секунд после начала мышечной работы.
3. Окислительное фосфорилирование.
Преимущества:
1. Это наиболее энергетически выгодный процесс - синтезируется 38 молекул АТФ при окислении одной молекулы глюкозы.
2. Имеет самый большой резерв субстратов: может использоваться глюкоза, гликоген, глицерин, кетоновые тела.
3. Продукты распада (CO2 и H2O) практически безвредны.
Недостаток: требует повышенных количеств кислорода.
Важную роль в обеспечении мышечной клетки кислородом играет миоглобин, у которого сродство к кислороду больше, чем у гемоглобина: при парциальном давлении кислорода, равном 30 мм.рт.ст., миоглобин насыщается кислородом на 100%, а гемоглобин - всего на 30%. Поэтому миоглобин эффективно отнимает у гемоглобин доставляемый им кислород.

В научной и врачебной практике давно сложилось мнение, согласно которому появление клеточных ферментов в крови является признаком цитолиза, разрушения клеток. Выход ферментов из разрушенных клеток и появление их в крови используется для прогноза течения заболевания, а также его исхода.
К важнейшим индикаторным ферментам относятся КК (креатинкиназа), АСТ (аспартатаминотрансфераза), АЛТ (аланинаминотрансфераза), ГГТ (гаммаглутамилтрансфераза), ЩФ (щелочная фосфатаза), ЛДГ (лактатдегидрогеназа).
КК влияет на уровень глюкозы в крови, снижает количество АДФ – одного из основных индукторов агрегации тромбоцитов и тромбообразования, участвует в адаптации миокарда, мозга, мышц к различному уровню кровоснабжения. Важнейшая роль КК связана с ее работой в ключевых точках метаболизма. Она регулирует процессы биологического окисления, обеспечивает транспорт макроэргов, в том числе АТФ, из митохондрий в цитоплазму, обеспечивает внутриклеточный баланс фосфора.
Помимо креатинкиназы, важнейшим ферментом является АСТ (аспартатаминотрансфераза). Это ключевой фермент обмена веществ, участвующий в обеспечении бесперебойной работы цикла трикарбоновых кислот, в котором вещества окисляются с выделением большого количества энергии. Субстраты этого фермента относятся к эволюционно наиболее древним органическим кислотам и присутствуют у всех живых существ.
АЛТ (аланинаминотрансфераза) обеспечивает работу глюкозо-аланинового шунта, благодаря которому глюкоза может превращаться в аланин, и наоборот. АЛТ контролирует уровень углеводов и белков в крови. Аланин, кроме того, является одной из транспортных форм аммиака, в обезвреживании которого участвует АЛТ. В целом, АЛТ занимает периферическую зону обмена веществ по сравнению с АСТ.
Повышение АСТ часто совпадает со снижением АЛТ и наоборот. С точки зрения одного лишь цитолиза это не очень непонятно, ведь эти ферменты родственны. Возможно, это указывает на активацию одних биохимических путей при одновременном торможении других. АСТ является индикатором центральных путей катаболизма, близких к циклу трикарбоновых кислот, а АЛТ – более периферических, с многочисленными пересечениями, путей обмена веществ.
ГГТ (гаммаглутамилтрансфераза) – фермент, отвечающий за транспорт аминокислот в клетки. Он составляет одну из детоксицирующих систем организма. Основная локализация – печень. Участвует в разрушении серотонина, гистамина, протеолизе денатурированных белков, поддержании постоянного уровня общего белка в крови. Является маркером интоксикации, аллергизации, выполняет роль аминокислотного насоса в клетки.
ЩФ участвует в процессах трансмембранного фосфорилирования, обеспечивая наряду с гормональной системой вход и выход глюкозы в клетки, что напрямую влияет на уровень глюкозы в крови. Также играет роль в поддержании уровня фосфатов, необходимых для биоэнергетики. Является маркером онтогенетической зрелости организма, компонентом фосфатно-буферной системы, одним из регуляторов трансмембранных потоков.
ЛДГ – фермент конечной реакции гликолиза. Катализирует обратимую реакцию перехода лактата в пируват и наоборот. В реакциях используется окисление-восстановление НАД, следовательно, реакция влияет на мембранный потенциал клетки, в частности, на связывание гемоглобина с кислородом в эритроцитах. Является маркером эритроцитарного пула. Также обеспечивает работу глюкозо-аланинового шунта. Реакция зависит от рН среды. В кислой среде она протекает в направлении гликолиза, в щелочной — в направлении глюконеогенеза. Фермент способен к образованию комплексов с фрагментами эритроцитарных мембран. Компонент буферной системы, маркер анаэробного токсикоза. Большая часть описанных ферментов задействованы в одних и тех же метаболических путях, причем на ключевых позициях. Они активно участвуют в процессах адаптации к нагрузкам, новым условиям среды и т.д. Ферменты, катализирующие важнейшие биологические процессы, имеют, как правило, период полужизни менее 20 ч, что является своего рода контролирующим механизмом.
Биохимия соединительной ткани.
Соединительная ткань составляет около половины от сухой массы тела.
Все разновидности соединительной ткани, несмотря на их морфологические различия, построены по общим принципам:
1. Содержит мало клеток в сравнении с другими тканями. В результате межклеточный матрикс занимает больше место, чем клетки и имеет сложный химический состав.
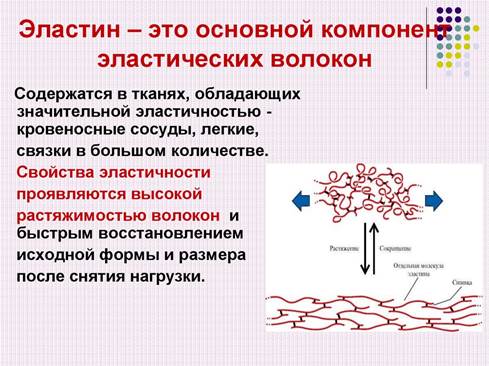
2. Основные компоненты межклеточного матрикса – структурные белки коллаген и эластин, гликозаминогликаны, протеогликаны, а также неколлагеновые структурные белки (фибронектин, ламинин, тенасцин, остеонектин и др.), которые образуют своеобразные волокнистые структуры.

Коллаген.
В межклеточном матриксе молекулы коллагена образуют полимеры, называемые фибриллами коллагена. Они обладают огромной прочностью и практически не растяжимы (они могут выдерживать нагрузку в 10 000 раз превышающую их собственный вес.

Существует ряд заболеваний, связанных с нарушением структуры или синтеза коллагена. Они составляют целую группу заболеваний соединительной ткани, названных коллагенозами. Так как около 50% всех коллагеновых белков содержится в тканях скелета, около 40% - в коже и 10% – в строме внутренних оганов, клиническая картина этих заболеваний будет крайне полиморфной. При многих заболеваниях наблюдаются не только костно-суставная патология или изменения со стороны кожи, но и ярко выраженные висцеральные проявления (поражения кишечника, почек, легких, сердца). К наиболее распространенным и изученным коллагенозам относят несовершенный остеогенез, а так же цингу.
По строению мономеров различают 7 типов ГАГ: (глюкозаминогликаны)
1. Гиалуроновая кислота 2. Хондроитин-4-сульфат 3. Хондроитин-6-сульфат 4. Дерматансульфат 5. Кератансульфат 6. Гепарансульфат 7. Гепарин

Вопросы:
1.Особенности метаболизма в скелетных мышцах и в миокарде. Креатинфосфат. ЛДГ. КФК. Углеводный обмен.
2. Белки мышечной ткани. Механизм мышечного сокращения и расслабления.
3.Биохимия сердца. Судьба лактата в сердечной мышце. Энзимодиагностика инфаркта миокарда.
4.Структурная организация и функции соединительной ткани. Классификация структурных белков соединительной ткани. Коллаген и эластин. Коллагеновые болезни.
Задачи:
1. Кошка не кастрированная, возраст около 12 лет. Стала плохо есть и пить (дня 3-4), периодически рвало (рот был каким-то очень бледным). У кошечки появилось ещё учащенное и шумное дыхание.
АСТ 156.90(20-55Е/л)
АЛТ 160.50(13-55Е/л)
ЛДГ 1170(46-350Е/л)
КФК 741(0-300Е/л)
Амилаза 3180(490-1000Е/л)
Об.билирубин 19.20(0-17мкмоль/л)
Пр.Билирубин 2.13(0-4мкмоль/л)
Об.белок 95(68-80г/л)
Альбумин 15.90(22-38г/л)
Глобулин 79(26-51г/л)
Альб/глоб 0.2(0.6-1.5)
Ca 1.68(2.23-2.8ммоль/л)
P 2.40(1.03-1.92ммоль/л)

2.