Содержание
История кафедры "Химическая технология неорганических веществ"
Значение фосфорной кислоты
История открытия и получения фосфорной кислоты
Физические свойства
Строение
Химические свойства Н3РО4
Значение фосфорной кислоты
Применение фосфорной кислоты
8. Получение экстракционной фосфорной кислоты в лабораторных условиях
Список используемой литературы
История кафедры "Химическая технология неорганических веществ"
Кафедра "Химическая технология неорганических веществ" была организована в 1962 году. Это первая кафедра в Республике Казахстан, которая готовила инженеров химиков-технологов широкого профиля. После организации кафедра выпустила более 2200 специалистов инженеров-технологов.
Кафедрой химическая технология неорганических веществ заведовали с 1962 г. по 1974 г. А.С. Сейтмагзимов, 1974-1976 гг. В.К. Бишимбаев, 1980-1985 гг. Г.Я. Попова. В 1985 году к кафедре "Химическая технология неорганических веществ" присоединили кафедру "Технология электротермических производств" и в 2010 году специализацию "Электрохимическая технология", до 1988 г. объединенной кафедрой "Технология неорганических веществ" заведовал О.М. Тлеукулов, в 1988-1991 гг. В.М. Шевко, с 1991 г. по 2005 г. кафедрой заведовал Ш.М. Молдабеков, с 2005-2006 г. - Б.С. Шакиров, с 2006-2011 г. - У. Бестереков, 2010-2011 учебный год - М.К. Жекеев, с 2011 г. - по настоящее время заведующим кафедрой является К.Т. Жантасов.
В 1995 года на кафедре открыта новая специализация "Химическая технология взрывчатых веществ и пиротехнических средств", а с 2008 года ведется подготовка по специализациям "Нанотехнология" и "Ядерно-химическая технология", "Мембранная технология". Обучение студентов ведется на трех языках - государственном, русском и английском.
На кафедре работали и работают известные ученые Ананьев Н.И. к.т.н., доцент; Шолаков А. к.т.н., доцент; Бугенов Е.С. д.т.н., профессор; Анарбаев А.А. д.т.н., профессор.; Гильманова Г.Б. к.т.н., доцент; Миркина Л.И. к.т.н., доцент; Айткулов Д.К. д.т.н., профессор; Оспанов С.С. к.т.н., доцент; Утебаев А.А. к.т.н., доцент; Тлеуова С.Т. к.т.н., доцент; Сатаев М.С. д.т.н., профессор; Кадырбаева А.А. к.т.н., доцент; Кошкарбаева Ш.Т. к.т.н., доцент; Каратаева Г.Е. к.т.н., доцент; Барлыбаев М.Р. к.т.н.; Болысбек А.А. к.т.н., доцент; старшие преподаватели Ескендирова М.М., Жулдызбаева С.Е.; Ермеков С.Р. магистр. Учебно-вспомогательный и инженерный состав кафедры высококвалифицированных специалистов: Травкина Н., Пахомова Т.Б., Кадынцева Т.А., Сарсенбиева Р.К., Пенин П.И., Карпунина Е.И., Васильева С.А., Кушербекова Г.Т. и другие.
На кафедре по специальности 05.17.01 - "Технология неорганических веществ" - успешно функционировала аспирантура и докторантура, которую окончили и защитили докторские диссертации Жантасов К.Т., Бажиров Н.С., Бестереков У., Анарбаев А.А., Батькаев И.И., Протопопов А.В., Айткулов Д.К., Жекеев М.К., Алтеев Т.А., Батькаев Р.И. и более 50 кандидатских диссертаций.
С 1995 года при кафедре функционирует магистратура, которую окончили и успешно защитили более 30 магистров и PhD докторантура с 2009 года, которую закончили 3 и обучаются 6 докторантов. PhD докторант Мырзахметова Б. в 2012 году защитила докторскую диссертацию и стала доктором философии по техническим наукам.
Более 50 выпускников кафедры продолжают научно-педагогическую деятельность в стенах ЮКГУ им. М. Ауезова.
В 2005 году д.т.н., профессорам кафедры Ш.М. Молдабекову, Б.С. Шакирову, Бишимбаеву В.К. и К.Т. Жантасову была присуждена Государственная премия в области науки, техники и образования Республики Казахстан. фосфорный кислота экстракционный лабораторный
Профессор кафедры К.Т. Жантасов в 2005году был удостоен звания в номинации "Лучший ученый года" Южно-Казахстанской области, а в 2008 году - профессор Шевко В.М.
Профессор кафедры В.М. Шевко стал стипендиатом Министерства образования и науки РК. В 2005/2006 году ст. преподаватель кафедры А.А. Болысбек удостоен звания "Лучший молодой преподаватель" по ЮКГУ им. М. Ауезова. В 2006 году академик Бишимбаев В.К. и профессор Шевко В.М. получили сертификаты за "Лучшую научно-исследовательскую работу" Министерства образования и науки РК.
Профессор кафедры Бестереков У.Б. в 2006 году был удостоен звания "Заслуженный работник образования Республики Казахстан", а в 2007 году "За развитие науки в Республике Казахстан". Профессор кафедры Жантасов К.Т. в 2006 году был удостоен звания "За развитие науки в Республике Казахстан", а в 2007 году получил грант "Лучший преподаватель ВУЗа" Республики Казахстан, в 2012 году доценту Тлеуовой С.Т. присвоено звание "Почетной работник образования РК"
В 2012 году профессор Молдабеков Ш.М. получил диплом №438 Международной Ассоциации Авторов Научных Открытий за открытие в области механики жидкости и газа и награжден памятной медалью Академии "Автору Научного Открытия".
Кафедра "Химическая технология неорганических веществ" в 2008 году прошла международную аккредитацию агентства ASIIN.
В 2008-2009 учебном году кафедра была признана "Лучшей кафедрой" ЮКГУ им. М. Ауезова.
В 2010 году специальность 5В072000- "Химическая технология неорганических веществ" ЮКГУ им. М. Ауезова заняла 1-е место по итогам номинации "Национальный рейтинг" в 2010 г. и 2012 г., проводимого НАЦ Министерства образования и науки РК.
В 2009 году студенческая работа Жумановой С. награждена медалью и дипломом I степени на Республиканском конкурсе научных студенческих работ фонда первого Президента РК.
Студенты Жуков А. (1995 г.), Жылкыбаев М. (2002 г.), Золин А.А. и Алтыбаев Ж.М. (2007 г.) получили диплом ІІІ-степени на Республиканском конкурсе научных студенческих работ. Студентка Кенжегулова А. на межвузовской олимпиаде по предметам специальности ХТНВ награждена дипломом ІІ-степени. В 2009-2010 учебном году студенты кафедры заняли 1-е командное место на Второй Республиканской олимпиаде по специальности 050720 "ХТНВ" (Шымкент, ЮКГУ им. М. Ауезова). На Республиканском конкурсе дипломных работ студенты кафедры Аминова Р., Мынбаева Ж. и Кенбаева К. награждены дипломами 1,2 и 3 степени (Шымкент, 2010 год). В 2010-2011 учебном году на 3-ей Республиканской олимпиаде по специальности студенты кафедры были отмечены: Байбосынов Ж. 1-е место, Тлеуова А. 2-е место, Сауранов М. 3-е место, а 2011 году на Республиканском конкурсе дипломных работ они награждены дипломами І, ІІ, ІІІ - степени (г. Шымкент). Студенты Сарсенбаев Н., Кыдыралиева А., Родина Н. на межвузовской олимпиаде 2012 года по предметам специальности 5В072000-ХТНВ награждены дипломом І-степени.
Кафедра имеет тесные связи с Российским химико-технологическим университетом им. Д.И. Менделеева, Санкт-Петербургским государственным техническим институтом (бывший Ленинградский технологический институт им. Ленсовета), Беларусским государственным технологическим институтом, Хемницким техническим университетом (Германия), Бранденбургским технологическим университетом (Германия).
Выпускниками кафедры являются Бишимбаев В.К. - депутат Мажилиса РК, бывший ректор ЮКГУ им. М. Ауэзова, ряд первых и вторых руководителей крупнейших предприятий Республики, таких как: ШАО "Фосфор" директор к.т.н. Жумартбаев Э.У., ТОО "Казфосфат" генеральный директор Искандиров М.З., НДФЗ директор Франгулиди Л.Х., ЗМУ директор к.т.н. Исаев Т.К., АО "Сары Тас" директор д.т.н. Алтеев Т., ТОО "РФС" Абдураев Р., ТОО "Казфосфат" (СМС) директор Иванов Н.Н., АО "Кайнар" директор к.т.н. Сарманов К.С., а также бывшие главные инженеры НДФЗ и ДПО "Химпром" д.т.н. профессор Бержанов Д.С., к.т.н. Барлыбаев М.Р. - ГИП ТОО "КазНИИХимпроект", директор ТОО "Химреактивсервис" Курманбеков Б., зам. генерального директора ТОО "КазНИИХимпроект" к.т.н. Карпенко В.А., декан ТарГУ им. Х.Дулати д.т.н. профессор Сахи М., директор колледжа №6 "Аулие ата" г. Тараз Жанкушиков И.Б., Тажибаев К.А., Сражиев С., д.т.н. профессор Омаркулов Т.О., Усупов О., Омаркулов Т.О. и многие другие.
В научном плане кафедра занимается проблемами утилизации техногенных отходов и термохимического обогащения природного минерального и вторичного сырья химической и урановой промышленности, а также электрохимическими процессами по нанесению антикоррозионных и огнезащитных покрытий на изделия, мембранной очисткой сточных и природных вод. Научной, научно-методической и профориентационной работой занимались все преподаватели кафедры.
. Профессор Жантасов К.Т. руководит одной из самых престижных для нашей республики работ по созданию технологии и разработке научных основ синтеза поликомпонентных минеральных удобрений со специфическими особенностями для сероземных почв. В работе принимают участие не только ППС кафедры но и студенты.
. Первой выпускницей Мырзахметовй Б РhD докторантуры. успешно зщищена докторская диссертация по специальности 05.17.01 "Технология неорганических веществ". Комитет по контролю в сфере образования и науки МОН РК утвердил ее РhD доктором наук, отметив при этом высокий уровень ее диссертации.
. На республиканской олимпиаде по специальности команда ЮКГУ в составе которой были студенты кафедры Бочкарева В. гр ХТ-09-1р., Кыдыралиева А. гр ХТ-09-1к9, Савченко Е гр ХТ-09-1р, Игнатенко О. гр ХТ-09-1р Сихымбай Н. студентка гр. ХТ-10-1к1 заняла первое командное место. Кроме того в личном зачете второе и третье место заняли соответственно Бочкарева В. гр ХТ-09-1р и Кыдыралиева А. гр ХТ-09-1к9. (Руководители Жантасов К.Т., Тлеуова С.Т. Сатаев М.С. Кадирбаева А.А.).
4. В журналы имеющие импакт-факторы и в журналы входящие в базу данных подано 5 статей. Иэ них опубликовано 1 статья Петропавловский И.А., Почиталкина И.А., Жантасов К.Т., Жантасов М.К., Лавров Б.А., Алтыбаев Ж.М., Франгулиди Л.Х. Получение офлюсованного агломерата фосфорита с улучшенными технологическими свойствами для производства фосфора.
Профессор Жантасов К.Т. руководит одной из самых престижных для нашей республики работ по созданию технологии и разработке научных основ синтеза поликомпонентных минеральных удобрений со специфическими особенностями для сероземных почв. В работе принимают участие не только ППС кафедры но и студенты.
Первой выпускницей Мырзахметовй Б РhD докторантуры успешно зщищена докторская диссертация по специальности 05.17.01 "Технология неорганических веществ". Комитет по контролю в сфере образования и науки МОН РК утвердил ее РhD доктором наук, отметив при этом высокий уровень ее диссертации.
На республиканской олимпиаде по специальности команда ЮКГУ в составе которой были студенты кафедры Бочкарева В. гр ХТ-09-1р., Кыдыралиева А. гр ХТ-09-1к9, Савченко Е гр ХТ-09-1р, Игнатенко О. гр ХТ-09-1р Сихымбай Н. студентка гр. ХТ-10-1к1 заняла первое командное место. Кроме того в личном зачете второе и третье место заняли соответственно Бочкарева В. гр ХТ-09-1р и Кыдыралиева А. гр ХТ-09-1к9. (Руководители Жантасов К.Т., Тлеуова С.Т. Сатаев М.С. Кадирбаева А.А.).
В журнале имеющий импакт-фактор опубликована статья авторов Петропавловский И.А., Почиталкина И.А., Жантасов К.Т., Жантасов М.К., Лавров Б.А., Алтыбаев Ж.М., Франгулиди Л.Х. Получение офлюсованного агломерата фосфорита с улучшенными технологическими свойствами для производства фосфора. // Научный журнал "Химическая промышленность сегодня", Москва, январь 2013 г. (База данных Scopus) и принята к изданию 2 статьи:
. M.Sataev, Sh.Koshkarbaeva, A. Tukibayeva, E. Tuleshova. "Obtaining of decorative coatings of the "crystallite" type on metallic and nonmetallic surfaces" // Asian Journal of Chemistry
2. M.S. Sataev <https://www.sciencedirect.com/science/article/pii/S0927775713001210>, S.T. Koshkarbaeva <https://www.sciencedirect.com/science/article/pii/S0927775713001210>, A.B. Tleuova <https://www.sciencedirect.com/science/article/pii/S0927775713001210>, S. Perni <https://www.sciencedirect.com/science/article/pii/S0927775713001210>, S.B. Aidarova <https://www.sciencedirect.com/science/article/pii/S0927775713001210>, P. Prokopovich <https://www.sciencedirect.com/science/article/pii/S0927775713001210>. Novel process for coating textile materials with silver to prepare antimicrobial fabrics //Colloids and Surfaces A: Physicochemical and Engineering Aspects
Профессор Жантасов К.Т. награжден дипломом Республиканского форума педагогов - новаторов.
За последний учебный год опубликовано в журналах имеющих импакт факторы и имеющих регистрацию в Скопусе 9 статей, в ВАКовских изданиях 7 статей. В изданиях России, Индии, Белоруссии 9.
Результаты НИР по проекту "Разработка новой, ресурсосберегающей технологии производства ферросплавов из необогатимых руд" внедрены в Таразском металлургическом заводе. Имеется акт внедрения.
Ведущие профессора Жантасов К.Т, Сатаев М.С, Бестереков У.Б активно участвовали в международных конференциях, проводимых за рубежом.
В России:
· XIII Всероссийской научно-практической конференции имени профессора Л.П. Кулёва студентов и молодых ученых. "Химия и химическая технология в XXI веке" Россия, г. Томск 2012 г.
· Международная научно-практическая конференция Технические науки - основа современной инновационной системы Россия, Республика Марий Эл, г. Йошкар-Ола - 2012.
В Норвегии:
· международный Евразийско-норвежский научный семинар (г. Осло).
В Белоруссии:
· Международная научно-практическая конференция
"Новейшие достижения в области импортозамещения в химической промышленности производстве строительных материалов", Минск, 22-23 ноября 2012 г.
1. Значение фосфорной кислоты
Фосфорная кислота имеет большое значение как один из важнейших компонентов питания растений. Фосфор используется растениями для построения своих самых жизненно важных частей - семян и плодов.
Производные ортофосфорной кислоты очень нужны не только растениям, но и животным. Кости, зубы, панцири, когти, иглы, шипы у большинства живых организмов состоят, в основном, из ортофосфата кальция. Кроме того, ортофосфорная кислота, образуя различные соединения с органическими веществами, активно участвуют в процессах обмена веществ живого организма с окружающей средой. В результате этого производные фосфора содержатся в костях, мозге, крови, в мышечных и соединительных тканях организмов человека и животных. Особенно много ортофосфорной кислоты в составе нервных (мозговых) клеток, что позволило А.Е. Ферсману, известному геохимику, назвать фосфор "элементом мысли".
Получение фосфорной кислоты в последнее время превращается в важное звено всей отрасли, связанной с производством удобрении. Известно, что ортофосфорная кислота (Р2О5 ЗН2О) при нагревании подвергается дегидратации, превращаюсь в пирофосфорную кислоту Р2О5 2Н2О. Дальнейшая дегидратация может привести к образованию триполифосфорной ЗР2О5 5НО и других полифосфорных вплоть до метафосфорной кислоты НРО3 и ее полимеров (Р2О5 Н2О)П. В производстве эту смесь называют суперфосфорной кислотой. Она содержит до 80% Р2О5, что превращает ее в ценное сырье для получения высококонцентрированных фосфорных и сложных удобрений.
Для этих целей ежегодно добывается во всем мире фосфорсодержащей руды около 100 млн. т. Фосфорные удобрения не только способствуют повышению урожайности различных сельскохозяйственных культур, но и придают растениям зимостойкость и устойчивость к другим неблагоприятным климатическим условиям, создают условия для более быстрого созревания урожая в районах с коротким вегетативным периодом. Они также благоприятно действуют на почву, способствуя ее структурированию, развитию почвенных бактерий, изменению растворимости других содержащихся в почве веществ и подавлению некоторых образующихся вредных органических веществ.
Немало ортофосфорной кислоты потребляет пищевая промышленность. Дело в том, что на вкус разбавленная ортофосфорная кислота очень приятна и небольшие ее добавки в мармелады, лимонады и сиропы заметно улучшают их вкусовые качества. Интересны и другие применения ортофосфорной кислоты в промышленности. Например, было замечено, что пропитка древесины самой кислотой и ее солями делают дерево негорючим. На этой основе сейчас производят огнезащитные краски, негорючие фосфодревесные плиты, негорючий фосфатный пенопласт и другие строительные материалы.
В 2005 г. мировое производство фосфорной кислоты достигло 34,6 млн. т Р2О5, увеличившись на 3,6% по сравнению с уровнем 2004 г. Мировая торговля фосфорной кислотой в 2005 г. выросла на 3% - до 5,0 млн. т Р2О5.
В период с 2006 по 2010 гг. мировые мощности по производству фосфорной кислоты возрастут, согласно прогнозу, на 5,4 млн. т и достигнут значения в 48.5 млн. т Р2О5 к 2010 г. Основные проекты по их увеличению будут осуществлены в Алжире, Китае, Египте, Марокко, России, Саудовской Аравии и Тунисе.
Мировые поставки фосфорной кислоты оцениваются в 35,4 млн. т в 2006 г. и достигнут 40,7 млн. т Р2О5 в 2010 (средний ежегодный рост - 3,7%). Принимая в расчёт использование фосфорной кислоты для производства удобрений и в других целях, средняя мировая потребность в ней будет расти на 3,3% в год и к 2010 г. достигнет 38,7 млн. т Р2О5. К 2010 г. превышение предложения фосфорной кислоты над спросом удвоится и достигнет 2,0 мл т Р2О5 из-за ввода в строй новых мощностей.
По оценке Сельскохозяйственного Комитета IFA мировая потребность в фосфорных удобрениях (Р2О5) в 2005 г. календарном году составит 37,7 млн. т Р2О5, что на 3% больше уровня 2006 г. К 2010 г. мировая потребность в фосфорных удобрениях должна достичь 41,5 млн. т Р2О5 (ежегодный прирост после 2007 г. - 2,5%).
Различные соли фосфорной кислоты широко применяют во многих отраслях промышленности, в строительстве, разных областях техники, в коммунальном хозяйстве и быту, для защиты от радиации, для умягчения воды, борьбы с котельной накипью и изготовления различных моющих средств.
Фосфорная кислота, конденсированные кислоты и дегидротированные фосфаты служат катализаторами в процессах дегидратирования, алкилирования и полимеризации углеводородов.
Все это позволяет сделать вывод, что фосфорная кислота является необходимым сырьем не только в химической промышленности, но и в пищевой.
. История открытия и получения фосфорной кислоты
Фосфорную кислоту открыл Р. Бойль с помощью индикаторов. Сжигая фосфор и растворяя образовавшийся белый продукт в воде он получил неизвестную химикам кислоту. По исходному веществу он назвал её фосфорной.
Технически фосфорную кислоту впервые получили более 100 лет назад разложением низкокачественных фосфоритов, содержащих значительные количества соединений трехвалентных металлов, разбавленной (5-10%) серной кислотой, в которой соединения железа и особенно алюминия переходят в раствор в незначительной степени.
Раствор с концентрацией 8-10% Р2О5 упаривали до содержания в нем примерно 40% Р2О5. При разложении фосфатной породы более концентрированной (30-40%) серной кислотой выделяются игольчатые кристаллы гипса. Они удерживают значительное количество жидкой фазы и плохо промываются. Вследствие этого потери Р2О5 велики.
Существенным шагом вперед в производстве фосфорной кислоты был переход к установкам непрерывного действия и разбавления 75 и 93% ной серной кислоты не водой или слабыми промывочными водами, а раствором фосфорной кислоты, т.е. проведение процесса с применением раствора разбавления. В этих условиях выделяются ромбические кристаллы, которые хорошо фильтруются и отмываются.
. Физические свойства
Ортофосфорная кислота в чистом виде при обычных условиях представляет бесцветные кристаллы ромбической формы, плавящиеся при температуре 42,3оС.
Однако с такой кислотой химики встречаются редко. Гораздо чаще они имеют дело с полугидратом Н3РО4 * 0,5 Н2О, который выпадает в виде бесцветных гексагональных призм при охлаждении концентрированных водных растворов ортофосфорной кислоты. Температура плавления полугидрата 29.3оС.
Чистая Н3РО4 после плавления образует вязкую маслообразную жидкость с малой электрической проводимостью и сильно пониженной способностью к диффузии. Эти свойства, а также детальное изучение спектров показывают, молекулы Н3РО4 в данном случае практически не диссоциированы и объединены прочными водородными связями в единую макромолекулярную структуру. Как правило, молекулы связаны друг с другом одной, реже двумя и очень редко тремя водородными связями.
Если же кислоту разбавлять водой, то ее молекулы охотнее образуют водородные связи с водой, чем друг с другом. Из-за таких "симпатий" к воде кислота смешивается с ней в любых отношениях. Энергия гидратации здесь не так велика, как у серной кислоты, поэтому разогревание Н3РО4 при разбавлении не столь сильное и диссоциация выражена меньше. По первой ступени диссоциации ортофосфорная кислота считается электролитом средней силы (25-30%), по второй - слабым, по третьей - очень слабым.
. Строение
Пространственное расположение атомов и длины связей в молекуле приводят к заключению, что связь Р = на самом деле не двойная, т.е. ее кратность не равна 2. Согласно расчетам кратность этой связи 1,74. Связь Р - О(Н) тоже не одинарная. Если ее кратность равнялась 1, то длина была бы 0,17 нм.
На самом деле в ортофосфорной кислоте и большинстве ее кислых солей длина этой связи 0,154-0,157 нм, что соответствует кратности 1,3-1,4.
Следовательно, электронная плотность двойной связи Р = О частично "растекается" по трем другим связям, слегка увеличивая их кратность. Кроме того, между атомами кислорода и фосфором возникает заметное донорно-акцепторное взаимодействие. Все это вместе взятое приводит к тому, что в Н3РО4 нет такого резкого различия в длинах связей, какое наблюдается у серной и азотной кислот. Длины связей Р = и Р - О(Н) оказываются почти выровненными, и остов молекулы превращается фактически в тетраэдр.
Разумеется, такая перестройка резко повышает устойчивость самой кислоты и ее производных. Отсюда следует своеобразная химическая пассивность ортофосфорной кислоты.
. Химические свойства Н3РО4
Ортофосфорная кислота в водных растворах намного слабее серной и азотной кислот. Это трехосновная кислота. Электролитическая диссоциация кислоты, как и других многоосновных кислот, осуществляется ступенчато:
Н3РО4-Н+ + Н2РО4- (I ступень)
Н2РО4- Н+ + НРО2- (II ступень)
НРО2- Н+ + РО43- (IIIступень)
Н3РО4 - 3Н+ + РО43- (Суммарное уранение)
Сравним значения констант ионизации кислоты соответствующих ступеней:
К1= 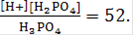
Как показывают эти данные, в растворе Н3РО4 в основном присутствуют дигидрофосфот-ионы Н2РО4-. Ионов, образующихся по второй ступени диссоциации, - гидрофосфат-ионов НРО4-, значительно меньше. И почти отсутствуют фосфат-ионы РО43- - продукты третьей, последней ступени ионизации. По первой ступени ионизации фосфорная кислота является кислотой средней силы. В соответствии с существованием трех видов кислотных остатков при нейтрализации фосфорной кислоты щелочами образуются соли: дигидрофосфаты, гидрофосфаты, а также фосфаты, например:
Н3РО4 + NaOH = NaH2PO4 + H2O
дигидрофосфат
натрияPO4 + 2NaOH = Na2HPO4 + 2H2O
гидрофосфат
натрияPO4 + 3NaOH = Na3PO4 + 3H2O
фосфат
натрия
Ортофосфорную кислоту можно отличить от других фосфорных кислот по реакции с нитратом серебра - образуется желтый осадок
Н3РО4 + 3AgNO3= Ag3PO4 + HNO3
фосфат серебра
Все остальные фосфорные кислоты образуют белые осадки.
. Значение фосфорной кислоты
Фосфорная кислота имеет большое значение как один из важнейших компонентов питания растений. Фосфор используется растениями для построения своих самых жизненно важных частей - семян и плодов.
Производные ортофосфорной кислоты очень нужны не только растениям, но и животным. Кости, зубы, панцири, когти, иглы, шипы у большенства живых организмов состоят, в основном, из ортофосфата кальция. Кроме того, ортофосфорная кислота, образуя различные соединения с органическими веществами, активно участвуют в процессах обмена веществ живого организма с окружающей средой. В результате этого производные фосфора содержатся в костях, мозге, крови, в мышечных и соединительных тканях организмов человека и животных. Особенно много ортофосфорной кислоты в составе нервных (мозговых) клеток, что позволило А.Е. Ферсману, известному геохимику, назвать фосфор "элементом мысли". Весьма отрицательно (заболевание животных рахитом, малокровие, и др.) сказывается на состоянии организма понижение содержания в рационе питания соединений фосфора или введение их в неусвояемой форме.
Физико-химические показатели экстракционной фосфорной кислоты
| Наименование показателя | Норма | |
| Экстракционная фосфорная кислота | Обесфторенная экстракционная фосфорная кислота | |
| Массовая доля экстракционной фосфорной кислоты (H3PO4), в пересчете на P2O5, %, не менее | ||
| Массовая доля сульфатов (H2SO4), %, не более | 2,5 | |
| Массовая доля нерастворимого в воде осадка, %, не более | ||
| Массовая доля фтора (F), %, не более | Не нормируется | 0,2 |
Физико-химические условия и конструктивное оформление разложение фосфата должны обеспечивать максимальное извлечение фосфорного ангидрида из фосфатита и получение кислоты с максимально возможной (при данном режиме) концентрацией.
. Применение фосфорной кислоты
Применяют ортофосфорную кислоту в настоящее время довольно широко. Основным ее потребителем служит производство фосфорных и комбинированных удобрений. Для этих целей ежегодно добывается во всем мире фосфоросодержащей руды около 100 млн. т. Фосфорные удобрения не только способствуют повышению урожайности различных сельскохозяйственных культур, но и придают растениям зимостойкость и устойчивость к другим неблагоприятным климатическим условиям, создают условия для более быстрого созревания урожая в районах с коротким вегетативным периодом. Они также благоприятно действуют на почву, способствуя ее структуированию, развитию почвенных бактерий, изменению растворимости других содержащихся в почве веществ и подавлению некоторых образующихся вредных органических веществ.
Немало ортофосфорной кислоты потребляет пищевая промышленность. Дело в том, что на вкус разбавленная ортофосфорная кислота очень приятна и небольшие ее добавки в мармелады, лимонады и сиропы заметно улучшают их вкусовые качества. Этим же свойством обладают и некоторые соли фосфорной кислоты. Гидрофосфаты кальция, например, с давних пор входят в хлебопекарные порошки, улучшая вкус булочек и хлеба.
Интересны и другие применения ортофосфорной кислоты в промышленности.
Например, было замечено, что пропитка древесины самой кислотой и ее солями делают дерево негорючим. На этой основе сейчас производят огнезащитные краски, негорючие фосфодревесные плиты, негорючий фосфатный пенопласт и другие строительные материалы.
Различные соли фосфорной кислоты широко применяют во многих отраслях промышленности, в строительстве, разных областях техники, в коммунальном хозяйстве и быту, для защиты от радиации, для умягчения воды, борьбы с котельной накипью и изготовления различных моющих средств.
Фосфорная кислота, конденсированные кислоты и дегидротированные фосфаты служат катализаторами в процессах дегидратирования, алкилирования и полимеризации углеводородов.
Особое место занимают фосфорорганические соединения как экстрагенты, пластификаторы, смазочные вещества, присадки к пороху и абсорбенты в холодильных установках. Соли кислых алкилфосфатов используют как поверхностно-активные вещества, антифризы, специальные удобрения, антикоагулянты латекса и др. Кислые алкилфосфаты применяют для экстракционной переработки урановорудных щелоков.
8. Получение экстракционной фосфорной кислоты в лабораторных условиях
. Цель и задачи: практическое изучение процесса получения экстракционной фосфорной кислоты разложением природных фосфатов серной кислотой в периодических и полунепрерывных условиях.
2. Оборудование, технические и инструментальные средства:
Установка для получения ЭФК Фильтровальная установка Сушильный шкаф Химическая посуда
Аналитические и технические весы Фотоэлектроколориметр Электроплитка
3. Краткие теоретические сведения
Экстракционную фосфорную кислоту получают разложением фосфатного сырья (апатитового концентрата или фосфорита) серной кислотой. В зависимости от состава исходного сырья и режима экстракции в кислоте могут содержаться различные примеси - соединения магния, кальция, железа, алюминия, фтора, серная кислота и др.
Основная реакция разложения фосфатного сырья:
Ca5F(PO4)3+5H2SO4+5nH2O=5CaSO4nH2O+3H3PO4+HF
Разложение фосфата проводят в течение 4-6 часов в присутствии раствора разбавления (фосфорной кислоты) для достижения максимального вскрытия сырья, поэтому вначале фосфат разлагается раствором разбавления:
Ca5F(PO4)3+(7+m)HЗРO4=5Ca(Н2РО4)2+mH3PO4+HF
Затем образовавшийся Ca(Н2РО4)2 реагирует с серной кислотой концентрации 75-93% в присутствии H3PO4:
Ca(Н2PO4)2+H2SO4+mH3PO4+nH2O=CaSO4nH2O+(m+2)H3PO4
Одновременно происходит разложение других минералов, входящих в
состав природного фосфата (соединений железа и алюминия, карбонатов кальция и магния и др.) Режим экстракции определяется формой образующегося кристаллогидрата сульфата кальция - ангидрита CaSO4, полугидрата CaSO40,5H2O или дигидрата CaSO42H2O и носит соответствующее название.
Дигидратный режим осуществляется при температуре 65-800C и концентрации P2O5 в жидкой фазе пульпы 18-32%, полугидратный - при температуре 90-1000C и концентрации P2O5 - 35-48%, ангидритный при температуре 105-1150C и концентрации P2O5 более 50%.
Для получения подвижной пульпы и крупных, хорошо фильтрующих кристаллов сульфата кальция поддерживают отношение между жидкой и твердой фазами пульпы в пределах от 2,5:1 до 3,5:1 с помощью раствора разбавления (раствора фосфорной кислоты концентрации 14-16% P2O5). Следовательно, разложение фосфатного сырья практически ведется смесью серной и фосфорной кислот по реакции: Режим экстракции определяется формой образующегося кристаллогидрата сульфата кальция - ангидрита CaSO4, полугидрата CaSO40,5H2O или дигидрата CaSO42H2O и носит соответствующее название. Дигидратный режим осуществляется при температуре 65-800C и концентрации P2O5 в жидкой фазе пульпы 18-32%, полугидратный - при температуре 90-1000C и концентрации P2O5 - 35-48%, ангидритный при температуре 105-1150C и концентрации P2O5 более 50%. Для получения подвижной пульпы и крупных, хорошо фильтрующих кристаллов сульфата кальция поддерживают отношение между жидкой и твердой фазами пульпы в пределах от 2,5:1 до 3,5:1 с помощью раствора разбавления (раствора фосфорной кислоты концентрации 14-16% P2O5). Следовательно, разложение фосфатного сырья практически ведется смесью серной и фосфорной кислот по реакции:
Ca5F(PO4)3+5H2SO4+mH3PO4+5nH2O=
=5CaSO4nH2O+(m+3)H3PO4+HF
Расчет расхода серной кислоты и раствора разбавления
Расход серной кислоты и раствора разбавления рассчитывают на заданное преподавателем количество фосфатного сырья определенного состава. Расход серной кислоты для разложения апатитового концентрата или фосфоритной муки рассчитывают по содержанию в них СаО.
Расход серной кислоты (S) в масс. единицах для разложения 100 масс. частей фосфатного сырья рассчитывают по формуле:
= 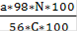
Где а - содержание СаО в фосфатном сырье, %; C - концентрация серной кислоты, %;
98 и 56- молярные массы серной кислоты и СаО;
N-норма серной кислоты, в процентах от стехиометрического количества.
Расход серной кислоты (V) в объемных единицах:
= 
где P- плотность раствора серной кислоты заданной концентрации, г/см3
Расход раствора разбавления (W) рассчитывают по формуле:
W=F-(100+S-G),
где F - выход продукционной пульпы из 100 масс. частей фосфатного сырья, рассчитывают по формуле:
=100Г(n+1),
Г - гипсовое число или выход сухого фосфогипса из единицы фосфатного сырья (в расчете на содержание СаО и нерастворимого остатка в фосфатном сырье). Для апатитового концентрата Г=1,6, для фосфорита Г=1,3-1,5. Так как состав фосфорита непостоянен, то желательно гипсовое число рассчитывать в каждом конкретном случае;- заданное отношение Ж:Т в пульпе (в пределах 2,5:1-3,5:1);масса газообразных потерь - воды, диоксида углерода, фтора при разложении 100 масс. частей фосфатного сырья.
Пример расчета для фосфоритной муки массой 100г, содержащей: P2O5-24,5%, F-2,0%, CO2-6,5%, MgO-2,5%, CaO-39,8% нерастворимый остаток (н.о.) -14%. Концентрация серной кислоты-75%, норма - 105% от стехиометрического количества, принимаем соотношение Ж:Т в экстракционной пульпе 3:1, масса испарившейся воды в расчете на 100г фосфоритной муки -3 г; считаем, что в газовую фазу выделяется весь диоксид углерода и 25% фтористых соединений.
Рассчитываем массу фосфогипса, который содержит CaSO4·2H2O и нерастворимый остаток фосфатного сырья:
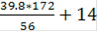 =136.24
=136.24
где 56 и 172 - молярные массы соответственно СаО и CaSO4·2 H2O.
Тогда гипсовое число:
Г= 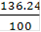 =1.3624
=1.3624
Расход серной кислоты концентрации 75% H2SO4 (плотность 1,669 г/см3)
= 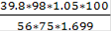 = 58.42см3
= 58.42см3
Выход пульпы:
=1 ×1,3624 ×(3 1) =681,21г
Масса газообразных потерь:
=6,5+3+2·0,25=10г
Расход раствора разбавления:
= 681,21 -(100+97,3-10)= 493,91 г
Описание установки.
Лабораторная установка для получения экстракционной фосфорной кислоты (рис 3) включает реактор-стакан 1 емкостью 400-500 мл с одной или двумя мешалками 5, приводимыми в движение электромоторами 4. Через отверстие в крышке стакана производится загрузка исходных материалов и отбор проб пульпы. Реактор помещен в водяной термостат 9, снабженный электронагревателем 6, отрегулированным на определенную температуру. Заданная температура поддерживается с помощью реле 8, связанного с нагревателем 6 и контактным термометром 7. Для предотвращения испарения воды в процессе экстракции реактор снабжен обратным холодильником 3.
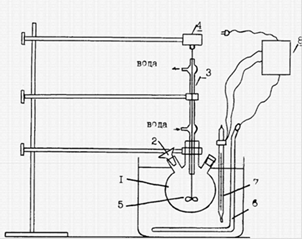
Рисунок 3. Схема установки для получения ЭФК:
- колба, 2 - воронка, 3 - обратный холодильник, 4 - моторчик, 5 - мешалка, 6 - нагреватель, 7 - контактный термометр, 8 - реле, 9 - термостат.
Порядок выполнения работы и обработка полученных результатов
В реактор 1, предназначенный для получения фосфорной кислоты, заливают рассчитанное количество раствора разбавления и серной кислоты, помещают реактор в водяной термостат, нагретый до температуры 70-1000C в зависимости от режима экстракции и включают мешалку 5. После прогрева смеси растворов в течение 30 мин постепенно всыпают в реактор при работающей мешалке заданное количество измельченного фосфатного сырья и отмечают время начала реакции. По согласованию с преподавателем загрузку в реактор исходных материалов можно осуществлять в такой последовательности: раствор разбавления - фосфатное сырье - серная кислота. Время начала реакции в этом случае отмечают от момента смешения фосфатного сырья с раствором разбавления. Разложение фосфатного сырья ведут в течение 2-4 часов.
По окончании опыта экстракционную пульпу фильтруют на воронке Бюхнера, создавая вакуум в колбе Бунзена (рис. 4.). Предварительно в воронку помещают фильтр и устанавливают разрежение на фильтровальной установке. Для этого включают вакуум-насос и при закрытом кране 3 с помощью крана 6 устанавливают разрежение 0,04-0,05 МПа, измеряемое вакуумметром 2. Затем экстракционную пульпу переносят на воронку, одновременно открывают кран 3 и засекают время начала фильтрования по секундомеру.