Федеральное бюджетное образовательное учреждение
Высшего профессионального образования
«САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ
МОРСКОЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
Гармашова И.В., Даниловская Л.П.
Методические указания для самостоятельной подготовки студентов к лабораторному занятию по теме
ЭЛЕКТРОХИМИЯ:
Гальванический элемент, электродные потенциалы
Санкт-Петербург
Краткие теоретические седения
Электрохимия - это раздел физической химии, изучающий взаимопревращение химической энергии в электрическую.
В технике применяется два основных электрохимических процесса, имеющих общую природу:
§ получение электрической энергии за счет химических реакций (химические источники тока);
§ протекание химических реакций под действием электрического тока (электролиз).
Взаимное превращение электрической и химической форм энергии происходит в электрохимических системах, состоящих из:
– проводников первого рода – веществ, обладающих электронной проводимостью и находящихся в контакте с электролитом - металлов;
– проводников второго рода – веществ, обладающих ионной проводимостью – электролитов.
ПОНЯТИЕ ОБ ЭЛЕКТРОДНОМ ПОТЕНЦИАЛЕ
При погружении металла в раствор происходит переход катионов с металла в раствор или из раствора на металл. На границе раздела двух фаз (металл-раствор) происходит перенос электрического заряда, т.е. протекает электрохимическая реакция, которая приводит к возникновению скачка потенциала.
Металлическая пластинка, погруженная в раствор электролита, называется электродом.
Переход ионов прекращается после установления динамического равновесия, заключающегося в том, что скорость растворения ионов равна скорости обратного процесса – выделения их на поверхность металла.
Возьмем две металлические пластинки, например, цинковую и медную. При погружении цинковой пластинки, более активного металла, в раствор соли цинка ZnSO4 происходит отрыв ионов цинка Zn2 + от кристаллической решетки металла под влиянием полярных молекул растворителя (рис.1). В результате перехода катионов в раствор металл приобретает отрицательный заряд за счет оставшихся на нем электронов, а прилежащий к нему слой раствора заряжается положительно за счет катионов, удерживаемых отрицательным зарядом металла. При погружении медной пластинки, менее активного металла, происходит процесс осаждения катионов из раствора на металле. Пластинка приобретает положительный заряд (рис. 1).

Рис. 1. Механизм возникновения электродного потенциала
Схема записи цинкового электрода: Zn|Zn2+
Реакция, протекающая в элементе:  D
D 
Схема записи медного электрода: Cu2+|Cu
Реакция, протекающая в элементе:  D
D 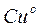
Переход заряженных частиц через границу «раствор-металл» сопровождается возникновением на границе раздела фаз двойного электрического слоя (ДЭС). ДЭС создается электрическими зарядами, находящимися на металле, и ионами противоположного заряда, ориентированными в растворе у поверхности электрода (рис.2).
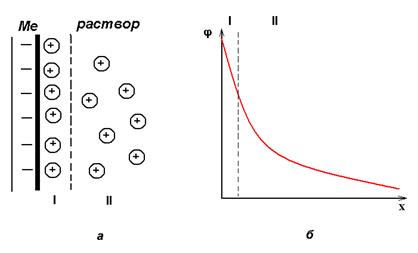
Рис. 2 Структура двойного электрического слоя
а – строение ДЭС;
б- распределение потенциала в ДЭС.
I – плотная часть ДЭС, II – диффузная часть ДЭС
Между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом или потенциалом электрода (φ). Эти потенциалы ограничивают процесс дальнейшего перемещения ионов с металла на металл. По мере удаления ионов от границы раздела величина потенциала в двойном электрическом слое убывает.
Потенциалы, возникающие на металлах, погруженных в растворы собственных солей, называются равновесными электродными потенциалами (φр).
Величина равновесного электродного потенциала зависит от природы электрода, температуры и концентрации ионов металла в растворе и выражается уравнением Нернста:
 , где [1]
, где [1]
где j 0 – величина стандартного электродного потенциала, измеренного при Т =298 К в растворе соли этого же металла с концентрацией ионов металла Men+, равной 1 моль/л (величины стандартных электродных потенциалов металлов указаны в ряду напряжений металлов; см. приложение №1);
R – универсальная газовая постоянная (8,314 Дж/моль·К)
T - температура в Кельвинах (K)
n – число электронов, участвующих в электродном процессе (или заряд катиона);
F – постоянная Фарадея (96,485 Кл/моль);
[Men+] – концентрация ионов Men+ в растворе (моль/л)
При температуре 250C и множителя 2,303 для перехода от натуральных логарифмов и десятичным комбинация физических констант в уравнении (1) будет иметь вид:


Таким образом, уравнение Нернста примет вид:
 [2]
[2]
Например, в электродной системе протекает полуреакция
 D
D 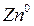
Следовательно, уравнение Нернста для цинкового электрода можно записать как:

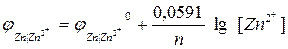
На металле, погруженном в электролит, не содержащий ионов этого металла (морская вода, раствор кислоты и т.п.), возникает неравновесный (коррозионный) потенциал ( ). В этом случае равновесия не наступает, т.к. в переносе электрических зарядов через границу раздела фаз участвуют разные ионы. Например, при растворении цинка в кислоте на цинке устанавливается неравновесный потенциал, определяемый реакциями:
). В этом случае равновесия не наступает, т.к. в переносе электрических зарядов через границу раздела фаз участвуют разные ионы. Например, при растворении цинка в кислоте на цинке устанавливается неравновесный потенциал, определяемый реакциями:
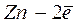 "
" 
 "
" 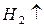
 "
" 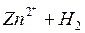
Значения абсолютных величин электродных потенциалов принципиально измерить невозможно. Следовательно, ограничиваются нахождением относительных величин электродных потенциалов по отношению к другому электроду, принятому в качестве стандартного электрода сравнения.
Основным стандартным электродом, потенциал которого условно принят за нуль, является водородный электрод (рис. 3). С ним сравнивают потенциалы других электродов.

Рис. 3. Схема устройства водородного электрода
Водородный электрод состоит из платиновой проволоки с приваренной к ней пластинки, покрытой платиновой чернью, погруженной в раствор кислоты с активностью ионов водорода, равной 1 моль/л. В сосуд подают химически чистый водород под давлением 1 атм.
Схема записи водородного электрода:
2 H+|H2(Pt).
На границе раздела фаз устанавливается равновесие:
 "
" 
Уравнение Нернста для расчета величины водородного электродного потенциала (n=1) имеет вид:
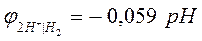 , [3]
, [3]
На практике для измерения электродных потенциалов металлов в качестве электрода сравнения не используют водородный электрод, т.к. он сложен в изготовлении и эксплуатации.
В качестве электрода сравнения используют хлорсеребряный электрод (см. приложение 2)
По величине стандартных электродных потенциалов (φ0) металлические электроды располагаются в определенной последовательности, называемой электрохимическим рядом напряжений (см. приложение1).Положительные величины φ0 указывают на то, что на данном электроде будет протекать реакция восстановления, а отрицательные величины φ0 соответствуют тому, что на нем пойдет процесс окисления. Чем меньше значение φ0 – потенциала, тем активнее металл.
Металлы с отрицательным значением потенциала вытесняют водород из растворов разбавленных кислот. Каждый металл способен вытеснять из растворов солей другие, менее активные металлы металлы, которые имеют большее алгебраическое значение потенциала. Так, если погрузить в раствор CuSO4 пластину из цинка, то часть ее растворится, а из раствора на поверхности пластины выделится красноватый слой меди:
 D
D 
Энергия этой окислительно-восстановительной реакции может быть превращена в электрическую энергию. Однако для этого необходимо пространственное разделение процессов окисления и восстановления.
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
Гальванические элементы относятся к химическим источникам электрического тока и позволяют получать ток за счет самопроизвольного протекания химической реакции.
Гальваническим элементом называется обратимая электрохимическая система, состоящая из двух электродов, погруженных в раствор электролита, в которой энергия окислительно-восстановительного процесса превращается в электрическую.
Гальванический элемент состоит из двух электродов, различающихся величиной φ-потенциалов. Электрод с меньшим значением φ-потенциала является анодом, а электрод с бỏльшим значением потенциала – катодом.
Устройство и принцип работы гальванического элемента можно рассмотреть на примере электрохимического элемента Якоби-Даниэля (рис. 4).

Рис. 4. Устройство элемента Якоби-Даниэля
Такой элемент имеет электроды из цинка и меди, погруженные в сернокислые растворы этих металлов. Емкости соединены между собой солевым мостиком, заполненным раствором хлорида калия (KCl).
При замыкании цепи гальванического элемента между цинковым электродом и раствором электролита идет реакция окисления, т.е. цинковая пластинка растворяется:
 "
" 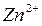
Ионы цинка из электрода переходят в раствор, а на электроде остаются электроны. Следовательно, цинковая пластинка заряжается отрицательно и становится анодом.
Между медным электродом и окружающим его раствором CuSO4 идет реакция восстановления:
 "
" 
Ионы меди из раствора осаждаются на медном электроде, который приобретает положительный заряд и становится катодом.
ЗАПОМНИТЕ! О к и с л е н и е – отдача электронов – происходит н а а н о д е, в о с с т а н о в л е н и е – приобретение электронов – н а к а т о д е. В гальваническом элементе анод имеет знак «-», а катод имеет знак «+».
Для гальванического элемента принята следующая форма записи:
 |
А(-) Zn | ZnSO4 || CuSO4 | Cu (+)К,
где вертикальная линия | обозначает границу раздела фаз, а двойная вертикальная линия || - солевой мостик. Гальванический элемент принято записывать так, чтобы анод находился слева.
Источником электрической энергии в элементе служит окислительно-восстановительная реакция, называемая суммарной или разрядной:
Cu2+ + Zn = Cu + Zn2+
или

Важнейшей характеристикой гальванического элемента является электродвижущая сила (ЭДС), которая определяется как предельная разность потенциалов, возникающая на границе раздела фаз в разомкнутой цепи элемента.

Э Д С – количественная характеристика эффективности работы гальванического элемента – она показывает, насколько полно осуществляется процесс перехода химической энергии в электрическую.
Величина Е всегда положительна (Е>0).
Для медно-цинкового гальванического элемента ЭДС равна:
 , т.е.
, т.е.

Работа гальванического элемента связана с уменьшением энергии Гиббса  G и может быть представлена как произведение переносимого электричества на величину ЭДС:
G и может быть представлена как произведение переносимого электричества на величину ЭДС:
А = -  G = nFE, где
G = nFE, где
 - заряд катиона;
- заряд катиона;  - число Фарадея,
- число Фарадея,  - стандартная ЭДС элемента.
- стандартная ЭДС элемента.