Задания для РГР
Из методички № 3635 (2009 год)
Тема 3. Основные закономерности протекания химических процессов
Задание. Дано уравнение реакции (см. вариант в табл. 3).
1. Для всех веществ, участвующих в реакции, выпишите из приложения 1 значения стандартных термодинамических величин 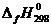 и
и 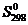 .
.
2. Вычислите изменение энтальпии реакции 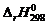 и определите, является ли данная реакция экзо- или эндотермической. Запишите термохимическое уравнение реакции.
и определите, является ли данная реакция экзо- или эндотермической. Запишите термохимическое уравнение реакции.
3. По виду уравнения реакции, не прибегая к расчетам, определите знак изменения энтропии реакции 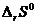 . Вычислив изменение энтропии реакции в стандартных условиях, объясните знак
. Вычислив изменение энтропии реакции в стандартных условиях, объясните знак 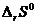 .
.
4. Вычислите энергию Гиббса прямой реакции в стандартных условиях 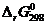 и установите возможность самопроизвольного протекания реакции.
и установите возможность самопроизвольного протекания реакции.
5. Определите температуру, при которой реакция находится в равновесии (Тр).
6. Рассчитайте 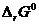 при Т=Тр–100, Т=Тр+100.
при Т=Тр–100, Т=Тр+100.
7. Постройте график зависимости 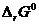 от Т и обозначьте на графике область температур самопроизвольного протекания реакции.
от Т и обозначьте на графике область температур самопроизвольного протекания реакции.
8. Вычислите значения константы равновесия Кc для температур: Т=Тр, Т=Тр–100, Т=Тр+100. Cделайте вывод о влиянии температуры на величину Кc и на смещение химического равновесия.
Таблица 3
| № варианта | 1, 2, 3 | Изменение внешних условий | |||||
| аА + bВ ó cC + dD | Cо (А), моль/л | Cо (В), моль/л | С исх | Р | V | Т | |
| CН4(г) + 2 Н2О(г) ó CO2(г) + 4 Н2(г) | ↑ | ↓ | ↓ | ↓ | |||
| СS2(г) + 4 Н2(г) ó CH4(г) + 2 Н2S(г) | ↑ | ↑ | ↑ | ↓ | |||
| SO2(г) + 3 F2(г) ó SF6(г) + О2(г) | ↓ | ↓ | ↑ | ↑ | |||
| 2 BCl3(г) + 3 Н2(г) ó 2 В(т) + 6 HCl(г) | ↑ | ↑ | ↓ | ↓ | |||
| 2 AsCl3(г) + 3 Н2(г) ó 2 As(г) + 6 HCl(г) | ↑ | ↑ | ↓ | ↓ | |||
| 2 Н2S(г) + 3 O2(г) ó2 SO2(г) + 2 Н2О(ж) | ↓ | ↓ | ↑ | ↑ | |||
| 2 NO(г) + 2 H2S(г) ó N2(г) + 2 H2O(г) + 2S(т) | ↑ | ↑ | ↓ | ↓ | |||
| СО(г) + 3 Н2(г) ó СН4(г) + Н2О(г) | ↓ | ↓ | ↑ | ↑ | |||
| 2 NO2(г) + F2(г) ó 2 (NO2)F(г) | ↓ | ↓ | ↑ | ↑ | |||
| 4 HCl(г) + O2(г) ó 2 Н2О(г) + 2 Сl2(г) | ↑ | ↑ | ↓ | ↓ | |||
| 2 CО(г) + SО2(г) ó 2 CО2(г) + S(т) | ↓ | ↓ | ↑ | ↑ |
Окончание табл. 3
| 2 NO(г) + 2 Н2(г) = N2(г) + Н2О(ж) | ↑ | ↑ | ↓ | ↓ | |||
| 2 NO(г) + 2 SO2(г) ó N2(г) + 2 SO3(г) | ↑ | ↑ | ↑ | ↑ | |||
| 2 PF3(г) + О2(г) ó 2 POF3(г) | ↓ | ↓ | ↑ | ↑ | |||
| 2 H2S(г) + SO2(г) ó 3 S(т) + 2 H2O(ж) | ↓ | ↓ | ↓ | ↓ | |||
| 2 PCl3(г) + O2(г) ó 2 PCl3O(г) | ↑ | ↑ | ↑ | ↑ | |||
| SiCl4(г) + 2 Н2(г) ó Si(т) + 4 HCl(г) | 0,5 | ↓ | ↓ | ↓ | ↓ | ||
| 2 NO(г) + Cl2(г) ó 2 NOCl(г) | ↑ | ↑ | ↑ | ↓ | |||
| 2 СО(г) + 2 Н2(г) ó СН4(г) + СО2(г) | ↓ | ↑ | ↑ | ↓ | |||
| CCl4(г) + 2 Н2(г) ó CН4(г) + 2 Cl2(г) | ↑ | ↓ | ↑ | ↑ | |||
| СO2(г) + 2 NH3(г) ó СО(NH2)2(т) + H2O(г) | 1,5 | ↑ | ↓ | ↓ | ↑ | ||
| 2 NO2(г) + O3(г) ó N2O5(г) + O2(г) | ↓ | ↑ | ↓ | ↑ | |||
| CS2(г) + 2 Сl2(г) = CCl4(г) + 2 S(т) | 1,5 | ↑ | ↓ | ↑ | ↑ | ||
| SiH4(г) + 2 O2(г) = 2 H2O(г) + SiO2(т) | 0,5 | ↑ | ↑ | ↓ | ↑ | ||
| 2 СН4(г) = С2Н2(г) + 3 H2(г) | – | ↓ | ↑ | ↑ | ↓ |
П р и л о ж е н и е 1
Термодинамические характеристики некоторых веществ
при 298 К
| Вещество | D f H °, кДж/моль | S°, Дж/(моль×К) | D f G°, кДж/моль |
| As(г) | 288,71 | 174,1 | 247,42 |
| AsCl3(г) | –270,34 | 328,82 | –258,04 |
| В(т) | 5,87 | ||
| BCl3(г) | –402,96 | 290,08 | –387,98 |
| ВаО(к) | –557,9 | 70,29 | –528,4 |
| ВаCl2(к) | –860,1 | –810,9 | |
| ВеО(к) | –598,7 | 14,1 | –581,6 |
| ВеCl2(к) | –494 | –468 | |
| Br2(г) | 30,92 | 245,35 | 3,14 |
| Сграфит | 5,74 | ||
| Салмаз | 1,83 | 2,38 | 2,85 |
| СО(г) | –110,5 | 197,54 | –137,14 |
| СО2(г) | –393,51 | 213,68 | –394,38 |
| СF4(г) | –933 | 261,4 | –888,37 |
| ССl4(г) | –106,7 | 309,7 | –63,95 |
| СН4(г) | –74,85 | 186,2 | –50,8 |
| С2Н2(г) | 226,75 | 200,82 | 209,21 |
| С2Н4(г) | 52,3 | 219,45 | 68,14 |
| С2Н6(г) | –84,68 | 229,5 | –32,89 |
| С6Н6(г) | 82,93 | 269,2 | 129,68 |
| СаО(к) | –635,5 | 39,7 | –605,2 |
| Са(ОН)2(к) | –986,2 | 83,4 | –898,5 |
| СаСО3(к) | –1207,1 | 92,88 | –1128,76 |
| Cl2(г) | 222,96 | ||
| ClF(г) | –49,9 | 217,82 | –51,37 |
| CuO(к) | –165 | 42,64 | –127 |
| Cu2О(к) | –173,2 | 92,93 | –150,5 |
| F2(г) | 202,67 | ||
| Вещество | D f H °, кДж/моль | S°, Дж/(моль×К) | D f G°, кДж/моль |
| FeO(к) | –263,8 | 58,8 | –244,3 |
| Fe2O3(к) | –822,16 | 89,96 | –740,98 |
| Н2(г) | 130,58 | ||
| HBr(г) | –35,98 | 198,5 | –53,5 |
| HCl(г) | –92,3 | –95,27 | |
| HF(г) | –268,61 | 173,51 | –270,7 |
| HI(г) | 25,94 | 206,3 | 1,3 |
| Н2О(г) | –241,82 | 188,7 | –228,61 |
| Н2О(ж) | –285,84 | 70,08 | –237,2 |
| Н2S(г) | –20,17 | 205,6 | –33 |
| I2(г) | 62,24 | 260,58 | 19,4 |
| N2(г) | 191,5 | ||
| NH3(г) | –46,19 | 192,66 | –16,66 |
| NF3(г) | –131,7 | 260,7 | –84 |
| N2F4(г) | –22 | ||
| N2O(г) | 82,01 | 219,83 | 104,12 |
| N2O3(г) | 90,22 | 307,1 | 110,5 |
П р о д о л ж е н и е п р и л. 1
| N2O4(г) | 11,11 | 304,35 | 99,68 |
| N2O5(г) | 13,3 | 355,65 | 117,14 |
| NO(г) | 90,25 | 210,62 | 86,58 |
| NO2(г) | 34,19 | 240,06 | 52,29 |
| NOCl(г) | 52,59 | 263,5 | 66,37 |
| NOF(г) | –51 | ||
| NOF3(г) | –187 | 277,6 | – |
| (NO2)F(г) | –109 | 259,3 | |
| NH4F(т) | –463,59 | 71,96 | –348,45 |
| СО(NH2)2(т) | –333,17 | 104,6 | –197,15 |
| CS2(г) | 116,7 | 237,7 | 66,55 |
| ССl4(г) | –106,7 | 309,7 | –63,95 |
| Cl2(г) | |||
| Вещество | D f H °, кДж/моль | S°, Дж/(моль×К) | D f G°, кДж/моль |
| О2(г) | 205,04 | ||
| О3(г) | 142,26 | 238,82 | 162,76 |
| РН3(г) | 5,44 | 210,1 | 13,39 |
| Р2О5(к) | –1492 | 114,5 | –1348,8 |
| PCl3(г) | –287 | 311,7 | –268 |
| PCl5(г) | –366,94 | 364,47 | –297,14 |
| PОCl3 (г) | –558,9 | 323,84 | –512,92 |
| F2(г) | 202,67 | ||
| PF3(г) | –956,5 | 272,6 | –935,66 |
| PОF3(г) | –1252,27 | 284,93 | –1203,75 |
| S(к) | 31,88 | ||
| SO2(г) | –296,9 | 248,1 | –300,4 |
| SO3(г) | –395,2 | 256,23 | –370,4 |
| SO2Cl2(г) | –363,17 | 311,3 | –318,85 |
| SF6(г) | –1207,08 | 291,62 | –1103,2 |
| Si(т) | 18,83 | ||
| SiCl4(г) | –657,52 | 330,95 | –617,6 |
| SiН4(г) | 34,73 | 204,55 | 57,19 |
| SiО2(к) | –903,5 | 46,86 | –850,7 |
Тема 6. Общие свойства растворов
Задание. Рассчитайте температуру кипения и замерзания раствора, состав которого представлен в таблице 7.
Температуры кипения, кристаллизации, криоскопическая и эбуллиоскопическая постоянные чистых растворителей приведены в приложении 4.
Таблица 7
| Номер варианта | Растворитель | Растворенное вещество | ||
| Вещество | масса, г | Вещество | масса, г | |
| Этанол С2Н5ОН | Сахароза С12Н22О11 | |||
| Вода Н2О | Мочевина (NH2)2СО | |||
| Уксусная кислота СН3СООН | Антрацен С14Н10 | 4,25 | ||
| Хлороформ СНCl3 | Пропеновая кислота С3Н4О2 | 7,2 | ||
| Этанол С2Н5ОН | Антраниловая кислота NH2C6H4COOH | 3,0 | ||
| Бензол С6Н6 | Камфора С10Н16О | 7,55 | ||
| Хлороформ СНCl3 | Нафталин С10Н8 | 2,1 | ||
| Вода Н2О | Глицерин С3Н5(ОН)3 | |||
| Этанол С2Н5ОН | Салициловая кислота С7Н6О3 | 11,4 | ||
| Сероуглерод СS2 | Бензойная кислота С6Н5СООН | 6,5 | ||
| Вода Н2О | Этиленгликоль (СН2)2(ОН)2 | |||
| Циклогексан С6Н12 | Пиррол С4Н5N | 2,5 | ||
| Бензол С6Н6 | Cера S | 11,6 | ||
| Диэтиловый эфир (С2Н5)2О | Анилин C6H5NH2 | 3,5 | ||
| Вода Н2О | Глюкоза С6Н12О6 | |||
| Бензол С6Н6 | Фенол С6Н6О | 1,75 | ||
| Вода Н2О | Метанол СН3ОН | |||
| Вода Н2О | Сахароза С12Н22О11 | |||
| Бензол С6Н6 | Трихлоруксусная кислота ССl3СООН | 3,27 | ||
| Уксусная кислота СН3СООН | Ацетон (СН3)2СО | 1,05 | ||
| Ацетон (СН3)2СО | Глицерин С3Н5(ОН)3 | 9,2 | ||
| Вода Н2О | Глюкоза С6Н12О6 | 4,84 | ||
| Четыреххлористый углерод CCl4 | Аспирин С9Н8О4 | 1,0 | ||
| Уксусная кислота СН3СООН | Антрацен С14Н10 | 2,5 | ||
| Вода Н2О | Мочевина (NH2)2СО |
П р и л о ж е н и е 4
Температуры кипения Ткип, кристаллизации Тплавл,
криоскопическая Ккр и эбуллиоскопическая Кэб постоянные
некоторых чистых растворителей
| Растворитель | Тплавл, °С | Ткип, °С | Ккр, 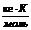
| Кэб,
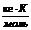
|
| Ацетон | –95,35 | 56,24 | 2,4 | 1,48 |
| Бензол | 5,53 | 80,1 | 5,12 | 2,57 |
| Вода | 1,86 | 0,52 | ||
| Диэтиловый эфир | –116 | 34,5 | 1,79 | 2,12 |
| Сероуглерод | –111,6 | 46,2 | 3,8 | 2,29 |
| Уксусная кислота | 16,75 | 118,1 | 3,9 | 3,07 |
| Циклогексан | 6,6 | 80,75 | 20,2 | 2,75 |
| Хлороформ | –63,5 | 61,2 | 4,9 | 3,61 |
| Четыреххлористый углерод | –22,96 | 76,75 | 29,8 | 5,25 |
| Этанол | –114,5 | 78,3 | 1,99 | 1,22 |