Задание на курсовую работу
Обосновать выбор реактора (адиабатический реактор идеального вытеснения или адиабатический реактор полного смешения) для проведения реакции окисления хлороводорода
Проанализировать изменение VR, выбравшего по п.1, от T0,P,x,ZA0, если через реактор проходит 25000 м3/ч исходной смеси.
Введение
Технология - учение о выгодных (т.е. поглощающих наименее труда людского и энергии природы) приемах переработки природных ресурсов в продукты, потребные (необходимые, или полезные, или удобные) для применения в жизни людей.
Происхождение слова «технология» (от греч. «technos» - искусство, ремесло и logos - учение, наука) вполне отвечает его содержанию: учение об умении, искусстве перерабатывать исходные вещества в полезные продукты.
Химическая технология представляет собой переработку, в процессе которой превалируют химические и физико-химические явления, что приводит к изменению состава, свойств и строения вещества.
Химическая технология - естественная, прикладная наука о способах и процессах производства продуктов (предметов потребления и средств производства), осуществляемых с участием химических превращений технически, экономически и социально целесообразным путем.
Химическая технология интегрирует в себе знания о химических превращениях, физико-химических свойствах и явлениях переноса, сведения из математики, механики, экономики и других наук и вырабатывает знания о взаимодействии отдельных явлений.
По мере развития химической промышленности содержание химической технологии обогащалось новыми сведениями, закономерностями. Значительный прогресс науки в последние годы связан с применением современных вычислительных средств для решения теоретических и прикладных задач.
Материальной основой всех химико-технологических процессов являются машины и аппараты химических производств. Эффективность химического производства обеспечивается за счет систематического повышения его технического уровня на основе использования мощных, непрерывных, малостадийных и менее энергоемких аппаратов. Так, выбор и расчет аппарата, ректификационной колонны, реактора является важным критерием, определяющим технологический процесс.
Краткие сведения о технологии окисления хлористого водорода
В последние десятилетия в промышленности органического синтеза все шире применяются хлор, хлористый водород и соляная кислота.
Разложение хлористого водорода воздухом было запатентовано в 1845 г. Окслэндом. Он предлагал пропускать смесь обоих газов через раскаленную пемзу, охлаждать и вымывать водой неразложившийся хлористый водород. В 1855 г. Фогель предложил для получения хлора использовать нагретую хлористую медь. В 1868 г. Дикон предложил комбинацию мыслей Окслэнда и Фогеля: непрерывный поток смеси хлористого водорода и воздуха пропускали через нагретую пемзу, пропитанную хлористой медью. В настоящее время окисляют не воздухом, а кислородом, что позволяет получить концентрированный хлор при применении высокоактивных катализаторов.
В настоящее время уделяется большое внимание созданию рациональных методов переработки и использования хлористого водорода, но процессы переработки абгазного хлористого водорода усложняется из-за наличия примесей органических веществ. Наиболее распространенным методом использования абгазного хлористого водорода является переработка его в соляную кислоту. Способы делятся на две группы. Первая группа базируется на получении хлора из газов, содержащих хлористый водород. К ней относятся каталитические методы окисления, процессы электролиза соляной кислоты, плазменные методы окисления хлористого водорода и другие. Вторая группа методов основывается на использовании абгазного хлористого водорода в качестве исходного сырья.
Окисление хлористого водорода кислородом также производят с помощью расплавленной смеси FeCL3 + KCL в две стадии, осуществляемых в отдельных реакторах. В первом реакторе происходит окисление хлорного железа с образованием хлора:
2FeCL3 + 1.5KCL= Fe2O3 +3CL2.
Во втором реакторе хлорное железо регенерируется из окиси железа хлористым водородом:
O3 + 6 HCL =2FeCL3 + 3H2O.
Процесс каталитического окисления хлористого водорода лучше осуществлять в аппарате, в котором контактная масса, состоящая из Fe2O3,KCL и хлорида меди, кобальта или никеля, нанесенных на инертный носитель, перемещается сверху вниз. В верхней части аппарата она проходит горячую зону хлорирования, где Fe2O3 превращается в FeCL3, взаимодействуя с HCL. Затем контактная масса опускается в зону охлаждения, где под действием кислорода образуется элементарный хлор, а FeCL3 переходит в Fe2O3.
Хлороводород
Хлороводород, а особенно его водный 37% раствор, известный как соляная кислота, кажется простым веществом. И действительно, его химическая формула - HCl - одна из самых коротких в неорганической химии. Между тем, вопреки, а может благодаря, своей простоте, хлороводород не только широко распространен в природе, но и выполняет множество ключевых функций. Например, соляная кислота - основной активный компонент желудочного сока человека и других млекопитающих. Без этого компонента, как несложно догадаться, питание людей было бы невозможно. То есть безо всякого преувеличения можно сказать, что на хлороводороде основано человеческое существование, хотя многие об этом и не задумываются.
Хлороводород (HCl) - бесцветный, термически устойчивый газ с резким запахом, дымящий во влажном воздухе, легко растворяется в воде (до 500 объемов газа на один объем воды) с образованием хлороводородной или соляной кислоты. Температура плавления: −115 °C (−158 K), температура кипения: −85 °C (−188 K), молекулярная масса - 70,9 а. е. м.
Соляная кислота - раствор хлористого водорода в воде; сильная одноосновная кислота. Бесцветная, «дымящая» на воздухе жидкость (техническая соляная кислота желтоватая из-за примесей Fe, Cl2 и др.). Максимальная концентрация при 20°С равна 38% по массе, плотность такого раствора 1,19 г/см³.
Физические свойства
| Конц (вес) <https://ru.wikipedia.org/wiki/Концентрация> c: kg HCl/kgКонц. (г/л) c: kg HCl/m³Плотность <https://ru.wikipedia.org/wiki/РџР> ρ: kg/lМолярность <https://ru.wikipedia.org/wiki/РњРѕР> M pH <https://ru.wikipedia.org/wiki/PH> Вязкость <https://ru.wikipedia.org/wiki/Вязкость> η: mPa·sУдельная тепло- емкость <https://ru.wikipedia.org/w/index.php?title=%D0%A3%D0%B4%D0%B5%D0%BB%D1%8C%D0%BD%D0%B0%D1%8F_%D1%82%D0%B5%D0%BF%D0%BB%D0%BE%D0%B5%D0%BC%D0%BA%D0%BE%D1%81%D1%82%D1%8C&action=edit> s: kJ/(kg·K)Давление пара <https://ru.wikipedia.org/w/index.php?title=%D0%94%D0%B0%D0%B2%D0%BB%D0%B5%D0%BD%D0%B8%D0%B5_%D0%BF%D0%B0%D1%80%D0%B0&action=edit> PHCl: PaТ кипения <https://ru.wikipedia.org/wiki/Температура_кипения> b.p.Т плавления <https://ru.wikipedia.org/wiki/Температура_РїР> m.p. | |||||||||
| 10 % | 104,80 | 1,048 | 2,87 M | -0,5 | 1,16 | 3,47 | 0,527 | 103 °C | −18 °C |
| 20 % | 219,60 | 1,098 | 6,02 M | -0,8 | 1,37 | 2,99 | 27,3 | 108 °C | −59 °C |
| 30 % | 344,70 | 1,149 | 9,45 M | -1,0 | 1,70 | 2,60 | 1,410 | 90 °C | −52 °C |
| 32 % | 370,88 | 1,159 | 10,17 M | -1,0 | 1,80 | 2,55 | 3,130 | 84 °C | −43 °C |
| 34 % | 397,46 | 1,169 | 10,90 M | -1,0 | 1,90 | 2,50 | 6,733 | 71 °C | −36 °C |
| 36 % | 424,44 | 1,179 | 11,64 M | -1,1 | 1,99 | 2,46 | 14,100 | 61 °C | −30 °C |
| 38 % | 451,82 | 1,189 | 12,39 M | -1,1 | 2,10 | 2,43 | 28,000 | 48 °C | −26 °C |
При 20 °C, 1 атм (101 kPa)
Производство хлороводорода
В лабораторных условиях соляную кислоту получают, воздействуя концентрированной серной кислотой на хлорид натрия (поваренную соль) при слабом нагревании:
+ H2SO4 = NaHSO4 + HCl
В промышленности соляную кислоту обычно получают прямым синтезом из простых элементов:
+ Cl2 = 2HCl
Применение хлороводорода
Применяют в гидрометаллургии и гальванопластике, для очистки поверхности металлов при паянии и лужении, для получения хлоридов цинка, марганца, железа и др. металлов. Составная часть желудочного сока; разведенную соляную кислоту назначают внутрь главным образом при заболеваниях, связанных с недостаточной кислотностью желудочного сока.
Соли соляной кислоты называются хлоридами, они чрезвычайно распространены и имеют широчайшее применение (галит, сильвин). При затвердевании даёт кристаллогидраты составов HCl·H2O, HCl·2H2O, HCl·3H2O, HCl·6H2O. В пищевой промышленности используется в качестве эмульгатора (пищевая добавка E507).
В смеси с азотной кислотой образует царскую водку.
Хлороводородный прорыв в биотехнологии
В природе ничего не происходит просто так. Вот и все более глубокие исследования простого вещества под названием хлороводород приносят больше и больше новых открытий. Надо заметить, что по объему сделанных вокруг этого химического соединения открытий хлороводород уступает только такому удивительному веществу, как вода, при этом с большим отрывом обгоняя спирты, липиды и даже белки, несмотря на куда как более сложное устройство последних.
Подтверждением удивительности хлороводорода служат и недавние открытия финских специалистов по прикладной биотехнологии из Свободного Университета Агрикультуры.
Действительно, новая работа вызвала большой интерес у компетентных специалистов и, по мнению последних, способна произвести широкий общественный резонанс. Исследования, о которых идет речь, связаны с диффузией молекул хлороводорода сквозь мембраны живых клеток при помещении последних в специальный раствор, содержащий слабо-концентрированную соляную кислоту. Как выяснилось, вопреки устоявшемуся среди биохимиков и биофизиков мнению, молекулярный хлороводород способен активно проникать внутрь клеток, не нарушая целостность клеточной мембраны. Правда, для этого необходимо присутствие в лабораторной среде ряда активирующих факторов, наиболее важным из которых являются возбужденные стиролом молекулы бутадиена.
Удивительный результат - открытие факта приобретения прошедшими сквозь лабиринты клеточной мембраны молекулами хлороводорода особых, ранее неизвестных свойств, существенных для внутриклеточной среды. Так, благодаря до конца не понятной цепочке процессов обмена электронами между диффундирующей молекулой хлороводорода и активными атомами углерода ряда белков, составляющих клеточную мембрану (в частности, по предварительным данным, важную роль тут играет холестерин), хлороводород оказывается способным сворачивать или, как говорят ученые, компактифицировать водородные связи внутриклеточной жидкости. В результате существующие внутри клетки молекулы реорганизуются в более компактную гелеобразную среду, сохраняя при этом способность к нормальной жизнедеятельности. Другими словами, клетка сворачивается сама в себя, резко уменьшаясь в объеме.
Полученные результаты имеют важное значение, особенно применительно к крупным организмам. Теоретически, при воздействии специальной хлороводородной уменьшающей среды на многоклеточный организм должно произойти синхронное сворачивание всех его клеток - в результате весь организм уменьшится. При этом, теоретически, он должен сохранить жизнеспособность.
Хлор
Хлор, химический элемент VII группы периодической системы, относится к галогенам. Атомный номер 17, относительная атомная масса 35,453. Природный хлор состоит из смеси двух изотопов - хлора-35 (75,77%) и хлора-37 (24,23%).
Свойства хлора. Хлор - тяжелый (в 2,5 раза тяжелее воздуха) желто-зеленый газ. Молекулы Cl2 легко диссоциируют на атомы при поглощении кванта света, а также при высокой температуре. При 730° С степень диссоциации составляет около 0,02%, а при 1730° С - уже почти 35%. При невысоких давлениях хлор близок к идеальным газам: 1 моль хлора при нормальных условиях занимает объем 22,06 л. При охлаждении до -34° С хлор сжижается, а при -101° С он затвердевает. Температуру сжижения газообразного хлора легко повысить, если увеличить давление; так при давлении 5 атм. хлор кипит уже при +10,3° С.
Хлор неплохо растворяется в воде: при 10° С в 1 л воды растворяется 3,15 л хлора, при 20° С - 2,3 л. Образующийся раствор обычно называют хлорной водой. Если насытить хлором при атмосферном давлении холодную (ниже 9,6° С) воду, из раствора выделяются желтоватые кристаллы состава Cl2·6H2O. Такие же кристаллы гидрата хлора образуются при охлаждении влажного газообразного хлора. Нагревая гидрат хлора в одном колене запаянной изогнутой трубки и охлаждая второе колено льдом, Фарадей в 1823 получил жидкий хлор. Хлор хорошо растворяется во многих органических растворителях; так, в 100 г холодного бензола растворяется около 35 г хлора.
Химически хлор очень активен. Он реагирует почти со всеми веществами, даже с платиной (при температурах выше 560° С). А в хлорной воде растворяется и золото. В 1869 профессор химии в Эдинбурге Джемс Альфред Уанклин заметил, что хорошо высушенный хлор не действует на железо и некоторые другие металлы. В результате появилось возможность хранить безводный жидкий хлор в стальных баллонах. Промышленное производство жидкого хлора было налажено в 1888 немецкой фирмой БАСФ.
Хлор активно и с выделением значительного количества тепла реагирует с водородом:+ H2 = 2HCl + 184 кДж. Реакция идет по цепному механизму, и если скорость ее инициирования велика (сильное освещение ультрафиолетовым или сине-фиолетовым светом, нагрев до высокой температуры), смесь газов (если хлора в ней содержится более 11,5 и менее 95%) взрывается.
Применение хлора.
Ежегодно во всем мире получают огромные количества хлора - десятки миллионов тонн. Только в США к концу 20 в. ежегодно путем электролиза получали около 12 млн. тонн хлора (10-е место среди химических производств). Основная его масса (до 50%) расходуется на хлорирование органических соединений - для получения растворителей, синтетического каучука, поливинилхлорида и других пластмасс, хлоропренового каучука, пестицидов, лекарственных средств, многих других нужных и полезных продуктов. Остальное потребляется для синтеза неорганических хлоридов, в целлюлозно-бумажной промышленности для отбеливания древесной пульпы, для очистки воды. В сравнительно небольших количествах хлор используют в металлургической промышленности. С его помощью получают очень чистые металлы - титан, олово, тантал, ниобий. Сжиганием водорода в хлоре получают хлороводород, а из него - соляную кислоту. Хлор применяют также для производства отбеливающих веществ (гипохлоритов, хлорной извести) и обеззараживания воды хлорированием.
Выбор адиабатического реактора для синтеза HCl
При сравнении работы реакторов полного смешения и идеального вытеснения, провели некоторый анализ зависимостей степени превращения, температуры и скорости реакции от времени пребывания в реакторе.

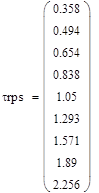
Анализ данных графических зависимостей показал, что степень превращения в РИВ больше, чем степень в РПС при одном и том же времени, а также температура имеет наибольшее значение, а следовательно и скорость реакции. Время на проведение реакции в реакторе полного смешения потребуется больше, чем в реакторе идеального вытеснения, что может привести к большим энергетическим затратам. Также необходимо учитывать тот факт, что в РИВ эффективнее протекают реакции при меньших тепловых эффектах. Для данной реакции выбран реактор идеального вытеснения.