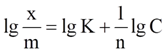Поверхностные явления. Адсорбция. Хроматография.
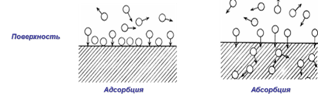
Адсорбция – процесс, самопроизвольного накопленияодного вещества на поверхности другого (экзотермический)
 Обратный процесс – десорбция (эндотермический)
Обратный процесс – десорбция (эндотермический)
Адсорбент – вещество, на поверхности которого происходит адсорбция.
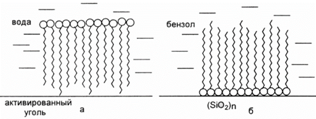
ü гидрофильные: силикагель, глины, пористое стекло
ü гидрофобные: активированный уголь, графит, тальк
Адсорбтив – вещество, которое накапливается на поверхности.
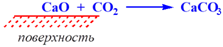 Абсорбция – поглощение вещества всей массой адсорбента.
Абсорбция – поглощение вещества всей массой адсорбента.
Хемосорбция – процесс сорбции одного вещества другим, при котором происходит химическое взаимодействие.
Причина адсорбции – уменьшение поверхностного натяжения (энергии)

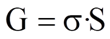 Поверхностное натяжениеσ –величина, измеряемая энергией Гиббса.
Поверхностное натяжениеσ –величина, измеряемая энергией Гиббса.
σ численно равна работе, которую необходимо совершить в данной системе для образования в ней единицы поверхности раздела фаз при постоянной температуре.

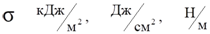
Каждая из «глубинных» молекул жидкости притягивается друг к другу.
Молекулы, находящиеся на поверхности, испытывают особенно сильное притяжение друг к другу.
Каждая жидкость с поверхности как бы покрыта особой самостягивающейся пленкой, состоящей из слоя толщиной в одну молекулу.
 Эти силы, стягивающие поверхность жидкости, и называются поверхностным натяжением.
Эти силы, стягивающие поверхность жидкости, и называются поверхностным натяжением.
Чем больше силы сцепления между молекулами, тем больше σ.
Значения σ
Этанол – 22.75 эрг/см2
Вода – 72.75 эрг/см2
Ртуть – 480.3 эрг/см2
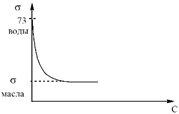
Поверхностная активность веществ
Изотерма поверхностного натяжения при добавлении к чистому растворителю различных веществ
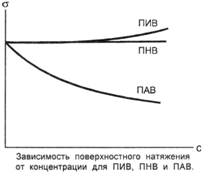
ПИВ ∆σ/∆С > 0 - кислоты, основания, соли
ПНВ ∆σ/∆С = 0 - глюкоза, сахароза
ПАВ∆σ/∆С < 0 - соли высших карбоновых кислот (мыла),
- высшие предельные спирты,
- ЧАО (четвертичные аммониевые основания) -основания тетраалкиламмония, а также его соли
Модель молекулы поверхностно-активного вещества:
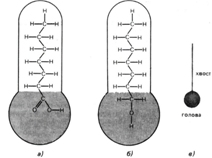 а — строение гептановой кислоты;
а — строение гептановой кислоты;
б – строение гептанового спирта;
в – модель молекул ПАВ.
Зависимость поверхностного натяжения от концентрации ПАВ
(изотерма поверхностного натяжения)

Антимикробное действие ПАВ связывают с их влиянием на проницаемость клеточных мембран, а также ингибирующим действием на ферментативные системы микроорганизмов.
Четвертичные аммониевые основания (ЧАО) обладают ярко выраженной антифаговой активностью.
Они приблизительно в 300 раз эффективнее фенола по губительному действию в отношении микроорганизмов и применяются в в хирургии в качестве антисептиков.


 Молекулярная адсорбция
Молекулярная адсорбция
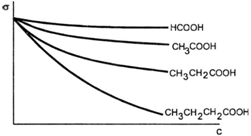
Изотерма поверхностного натяжениягомологического ряда карбоновых кислот.
Биологическая активность (наркотическое действие, бактерицидность) веществ одного и того же гомологического ряда возрастает с увеличением их поверхностной активности по
правилу Дюкло-Траубе
Правило Дюкло–Траубе.
Увеличение радикала на одну –СН2– группу увеличивает адсорбцию органических веществ в полярном растворителев 3-3,5 раза.
СН3-СООН СН3-(СН2)4–СООН
Адсорбция капроновой кислоты выше в 34=81 раз, чем уксусной
 Связь σ с концентрацией.
Связь σ с концентрацией.
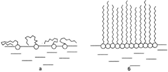 Молекулы ПАВ на поверхности воды:
Молекулы ПАВ на поверхности воды:
а- при малых концентрациях,
б- в мономолекулярном слое.
Уравнение Гиббса
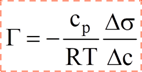
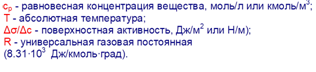
Правило Ребиндера
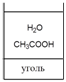 В первую очередь из растворов адсорбируютсявещества полярность которых ближе к полярности
В первую очередь из растворов адсорбируютсявещества полярность которых ближе к полярности
адсорбента (с наименьшей диэлектрической проницаемостью)
ε угля = 1 <ε уксусной к-ты = 6 <ε воды = 81
Изотермы адсорбции
 1. Изотерма Ленгмюра
1. Изотерма Ленгмюра
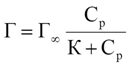
Г∞ - предельная величина адсорбции;
К - константа адсорбционного равновесия (отношение констант скоростей процессов десорбции и адсорбции);
Ср - равновесная концентрация адсорбтива
ü гладкие адсорбенты;
ü концентрации адсорбтивабольшие и малые;
ü границы раздела фаз: тв – г, тв – ж, ж – ж;
ü слой мономолекулярный.
Изотерма Ленгмюра для границы раздела«твердое вещество-газ»
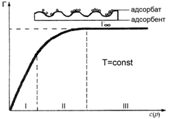
Изотерма мономолекулярной адсорбции
Изотерма Ленгмюра для границы раздела«жидкость–газ»

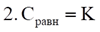
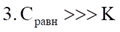
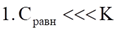
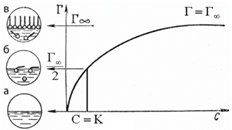

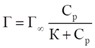
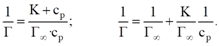


Определение констант изотермы адсорбции Ленгмюра
«Частокол» Ленгмюра.
Определение длины молекул ПАВ.

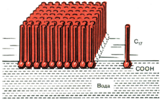
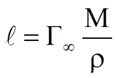
Ориентация молекул стеариновой кислоты на поверхности воды.
Представления об ориентации молекул ПАВ в насыщенномадсорбционном слое сыграло важную роль в развитии учения о структуре биологических мембран.
 В 1925 году Е.Горшнер и Г.Грендел установили, что площадь мономолекулярного слоя липидов вдвое больше суммарной поверхности эритроцитов. Используя этот факт, Ф.Даниэли и Г.Давсон предложили (1933) модель биологической мембраны основным элементом которой является бимолекулярный слой из липидов.
В 1925 году Е.Горшнер и Г.Грендел установили, что площадь мономолекулярного слоя липидов вдвое больше суммарной поверхности эритроцитов. Используя этот факт, Ф.Даниэли и Г.Давсон предложили (1933) модель биологической мембраны основным элементом которой является бимолекулярный слой из липидов.
Полярные группировки липидов направлены наружу, неполярные - внутрь.
1 – липидный бислой;
2 – мономолекулярный слой белков;

 2. S-образная изотерма БЭТ (Брунауэр, Эммет, Теллер)
2. S-образная изотерма БЭТ (Брунауэр, Эммет, Теллер)
ü поверхность гладкая;
ü концентрации средние и высокие;
ü границы раздела фаз: тв-г, тв-ж, ж-г, ж-ж;
ü слой полимолекулярный.
Изотерма Фрейндлиха
ü 
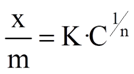 адсорбент пористый;
адсорбент пористый;
ü концентрации средние;
ü границы раздела фаз:тв-г, тв-ж.
 Графическое определение К и n из уравнения Фрейндлиха
Графическое определение К и n из уравнения Фрейндлиха
 |

График для определения констант уравнения
адсорбции Фрейндлиха
 |