Количественные показатели коррозии
Согласно ГОСТ 5272-68, 9020-74, 17332-71 и литературным сведениям процесс коррозии металлических материалов оценивают с учетом следующих количественных показателей:
Средняя скорость коррозии (коррозионные потери с единицы поверхности металла в единицу времени)
К- = 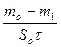 , г/(м2.ч) - по убыли массы
, г/(м2.ч) - по убыли массы
К+ = 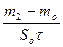 , г/(м2.ч) - по увеличению массы,
, г/(м2.ч) - по увеличению массы,
где mo, m1, m2 - масса образца соответственно исходного, после коррозионного испытания и с продуктами коррозии; So - площадь, м2; t - время, ч.
По величине средней скорости коррозии находят балл, характеристику устойчивости металла и коррозионную активность среды (см. табл. 1).
Таблица 1.
Десятибалльная шкала оценки коррозионной устойчивости материалов и коррозионной активности среды
| Балл | Скорость проникновения коррозии, мм/год | Скорость коррозии железа и железных сплавов, г/м2.ч | Характеристика устойчивости металлов | Коррозионная активность среды |
| 0,001 0,001-0,005 0,005-0,01 0,01-0,05 0,05-0,1 0,1-0,5 0,5-1,0 1,0-5,0 5,0-10,0 >10,0 | 0,0009 0,0009-0,0045 0,0045-0,009 0,009-0,045 0,045-0,09 0,09-0,45 0,45-0,9 0,90-4,5 4,5-9,0 >9,0 | Полностью устойчив Повышенная устойчивость То же Устойчивый То же Пониженная устойчивость То же Слабоустойчивый То же Неустойчивый | Неактивная Низкая То же Средняя То же Повышенная То же Высокая То же Очень высокая |
2. Используя лишь весовой показатель коррозии, не представляется возможным сравнить между собой коррозионную стойкость металлов, сталей и сплавов с различной плотностью. Исправить этот недостаток можно, применив глубинный показатель коррозии П (т.е. глубину коррозионного разрушения металла в единицу времени), который учитывает плотность материала и выражается уравнением:
П = К±/r, г/(м2.ч)/(г/см3),
где r - плотность материала, г/см3; К± - средняя скорость коррозии, г/(м2.ч). После преобразования для расчета глубинного показателя коррозии получаем новое уравнение: П = 8,76К±/r, мм/год.
3. Механический показатель коррозии - изменение какого-либо показателя механических свойств металла, %:
Кs =  ,
,
где sо = Ро/So - предел прочности; Ро - разрушающая нагрузка до коррозии; So - начальная площадь сечения образца; s, = Р1 / So - предел прочности металла после коррозии; Р1 - разрушающая нагрузка после коррозионного испытания в течение t, час.
4. Измерение электрического сопротивления образца:
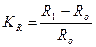 ,
,
где Ro, R1 - электрическое сопротивление образца соответственно до коррозии и после коррозионного испытания в течение t: час. (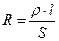 ).
).
5. Масса металла, электрохимически удаляемая с анода определяется по закону Фарадея:
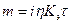 ,
,
где Кэ - массовый электрохимический эквивалент вещества, г/(А.ч); i - сила тока, А; t - время, ч; h - выход по току.
Электрохимический эквивалент металла выражается формулой:
Кэ = А/(nF),
где А - атомная масса металла; n - валентность металла; F - постоянная Фарадея (в расчете на эквивалентную массу, А/n) равна 26,8 А.ч.
Электрохимический эквивалент для сплавов определяется по уравнению:
 ,
,
где Р1. Р2,…Рn - содержание компонентов сплава, масс.%; Кэ.1. Кэ.2…- электрохимические эквиваленты компонентов, г/(А.ч).
С использованием закона Фарадея рассчитывается токовый показатель коррозии по уравнению:
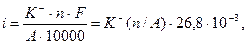 А/см2,
А/см2,
где 26,8 - постоянная Фарадея, А.ч; К- - отрицательный весовой показатель коррозии, г/(м2.ч); А - атомная масса, а.е.м.
6. Объемный показатель коррозии (объем поглощенного или выделившегося в процессе коррозии металла газа, приведенный к нормальным условиям и отнесенный к единице поверхности металла и к единице времени):
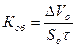 , см3/(см2.ч);
, см3/(см2.ч); 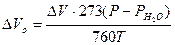 ,
,
где DVo - объем выделившегося (поглощенного) газа, см3; 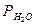 - парциальное давление паров воды
- парциальное давление паров воды

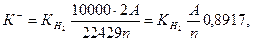 г/(см2.ч)
г/(см2.ч)
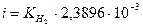 , А/см2,
, А/см2,
где i и 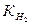 - соответственно токовый и объемный (по водороду) показатели коррозии; 22429 см3 - объем грамм -молекулы Н2 при 273 К и 1,01.105 Па.
- соответственно токовый и объемный (по водороду) показатели коррозии; 22429 см3 - объем грамм -молекулы Н2 при 273 К и 1,01.105 Па.
7. Глубина межкристаллитной коррозии оценивается как по изменению электрического сопротивления, так и прочностного показателя. В частности, для тонколистового металла и проволоки степень поражения поперечного сечения образца межкристаллитной коррозией рассчитывается по уравнению:
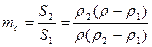 ,
,
где S2 - площадь поперечного сечения металла, пораженного межкристаллитной коррозией; S1 - его площадь до коррозии; r2 - удельное электрическое сопротивление металла, пораженного коррозией;  - удельное электрическое сопротивление образца после коррозии, получаемое из опыта; R - электрическое сопротивление образца после коррозионного испытания; l - его длина, см; r1 - удельное электрическое сопротивление слоя не пораженного коррозией металла.
- удельное электрическое сопротивление образца после коррозии, получаемое из опыта; R - электрическое сопротивление образца после коррозионного испытания; l - его длина, см; r1 - удельное электрическое сопротивление слоя не пораженного коррозией металла.
Металл принято считать подверженным межкристаллитной коррозии, если глубинный показатель коррозии, вычисленный по изменению электросопротивления, больше глубинного показателя коррозии, вычисленного по потере веса образца. Для этих целей можно сопоставить опытное значение (КR)выч 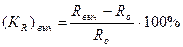 ,
,
где Rвыч - электросопротивление образца, вычисленное из весовых потерь (за время t, час) по уравнению:
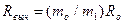 , Ом,
, Ом,
где mo и m - масса образца до и после коррозионного испытания; Ro - электросопротивление образца до коррозионного испытания. По мере роста r2 во времени отношение [r2/(r2 - r1)] стремится к единице. С учетом этого отношения получено новое уравнение для оценки коррозионного разрушения:
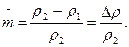
Данное приведенное отношение 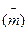 - количественный показатель, характеризующий степень поражения межкристаллитной коррозией поперечного сечения образца.
- количественный показатель, характеризующий степень поражения межкристаллитной коррозией поперечного сечения образца.
8. Аналитический метод определения скорости коррозии может быть применен в том случае, когда продукты коррозии полностью растворимы в агрессивной среде. О скорости коррозии судят по изменению химического состава среды, по количеству появившихся в электролите солей данного металла или сплава. Это позволяет дифференцировать убыль веса образца в процессе коррозии.
Аналитический метод мало эффективен тогда, когда продукты коррозии или плохо, или полностью нерастворимы в контактирующем с металлом растворе (расплаве) и довольно прочно удерживаются на металлической поверхности.
9. Метод идеальных поляризационных кривых нашел применение при изучении процесса коррозии в водных электролитах (в последнее время и в расплавах солей).
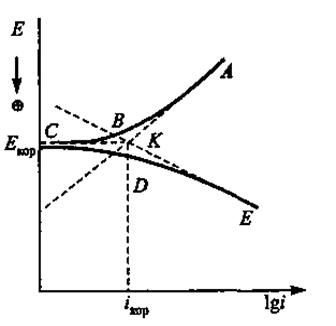
В указанных средах анодная и катодная поляризация проявляются при плотностях тока, превышающих коррозионный ток (ток саморастворения изучаемого металла). Определяя на опыте анодную и катодную поляризацию металла в зависимости от плотности тока можно по пересечению прямолинейных участков идеальных поляризационных (А и К) кривых найти imax - плотность максимального коррозионного тока и далее по закону Фарадея рассчитать убыль массы образца:
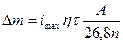 ,
,
где t - время (когда коррозия принимает примерно постоянное значение через промежуток времени t); А - атомная масса; n - степень окисления катионов; h - выход металла по току.
|
Настоящий расчет максимального коррозионного тока можно осуществить и на основании анодных реальных поляризационных кривых, полученных в потенциодинамическом (или гальваностатическом) режиме, когда средняя скорость коррозии неполяризуемого электрода невелика и внешний задаваемый анодный ток может быть принят равным общей скорости растворения электрода.
Метод идеальных поляризационных кривых позволяет определить величины средней скорости коррозии, удовлетворительно согласующиеся с результатами методов весового, аналитического и потенциалов коррозии. Совпадение данных величин указывает на электрохимический механизм процессов коррозии металлов или сплавов в агрессивной среде. Если такого совпадения не наблюдается, это указывает на то, что процесс коррозии материала в электролите протекает одновременно как по электрохимическому, так и химическому механизму.
Доля электрохимического механизма коррозии может быть рассчитана по уравнению
Дэ-х = (imax/iопыт) ×100%,
где imax и iопыт - плотности максимального коррозионного тока, найденные соответственно методом поляризационных кривых и гравиметрическим (весовым) методом. Если опытным путем установлено, что imax < iопыт, то это указывает на преимущество в окислении металлов в коррозионной среде химического механизма процесса коррозии. Возможны случаи обратного соотношения imax > iопыт при условии протекания процесса избирательной коррозии (при исключении внешней анодной поляризации) по гетерогенно-электорхимическому механизму, когда электрод имеет крупнокристаллическую структуру и его разрушение сопровождается окислением одной структурной составляющей или одного легирующего компонента сплавов или сталей.
10. Кроме перечисленных методов процесс электрохимической коррозии возможно исследовать также методом радиоактивных индикаторов, вращающегося дискового электрода или вращающегося дискового электрода с кольцом.