Зависимость энергии притягивающихся двух нуклонов от расстояния между ними описывается формулой потенциала Юкавы: 
Она вытекает из так называемой обменной модели взаимодействия. Механизм обменного взаимодействия качественно можно понять с помощью принципа неопределенностей.
Рассмотрим обменный механизм адронного взаимодействия протона и нейтрона (механизм связи ядра дейтерия). В этой модели нейтрон рассматривается как связанное состояние протона p и отрицательного пиона p—. Энергия связи пиона и протона почти равна энергии покоя пиона (140 МэВ), поэтому инвариантные массы протона и нейтрона отличаются мало. На пион приходится энергия, почти равная нулю. Тем не менее, принцип неопределенности позволяет пиону пребывать на некотором удалении от протона. Пион, находящийся вне протона, образует виртуальное облако амплитуды вероятности. Виртуальность означает “невозможную возможность”. “Невозможность” относится к тому, что оказавшийся вне протона пион, как и внутри, должен иметь полную энергию, почти равную нулю. Но тогда из выражения энергии
E2=(pc)2+(m0c2)2 (4)
следует, что квадрат импульса отрицательный, что по классическим представлениям невозможно. “Возможность” же означает, что облако дает реально наблюдаемый эффект связи нуклонов.
Если к представлению о виртуальном пионе применить принцип суперпозиции, то виртуальный пион “находится” одновременно в двух состояниях — существует и не существует.
5.1. Молекулярно-кинетическая теория строения вещества дает стройное объяснение существованию трех агрегатных состояний - твердого, жидкого и газообразного, а также перехода вещества из одного состояния в другое, основываясь на различных силах притяжения и отталкивания, действующих между молекулами.
Основные положения:
1. Все тела состоят из частиц
2.Частицы находятся в постоянном беспорядочном движении.
3. Между молекулами и атомами действуют силы притяжения и отталкивания.
Статистический метод (использование средних значений физ.величин)
При изучении систем многих частиц информация должна иметь обобщенный характер и относиться не к отдельным частицам, а к совокупности большого числа частиц. Соответственно, понятия также должны относиться не к отдельным частицам, а к большим совокупностям. Используются также и для описания поведения систем с небольшим числом степеней свободы, если в поведении этих систем существенны квантовые эффекты. Макроскопические характеристики тел имеют физический смысл лишь в случае большого числа молекул. Статистический метод позволяет понять суть явлений, установить связь поведения системы в целом с поведением и свойствами отдельных её частиц.
Распределение молекул идеального газа по состояниям – распределение Больцмана
 , где
, где  — среднее число частиц, находящихся в
— среднее число частиц, находящихся в  -ом состоянии с энергией
-ом состоянии с энергией  , а константа
, а константа  определяется условием нормировки:
определяется условием нормировки:  , где
, где 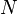 — полное число частиц.
— полное число частиц.
5.2. Термодинамический метод характеризуется своей общностью, он позволяет изучать явления без знания внутренних механизмов. Оценка состояния термодинамической системы по макроскопическим параметрам: T, V, P.
Связь между P, Vm, Eср.кин:  ; Связь между P, Vm, T:
; Связь между P, Vm, T:  ;
;
Физический смысл T:  ,
,  , где k- постоянная Больцмана
, где k- постоянная Больцмана
Основное уравнение идеального газа:  , p = nkT
, p = nkT
 Внутренняя энергия:
Внутренняя энергия: 
5.3. Уравнение состояния идеального газа (у-ие Менделеева-Клайперона): 
Изопроцессы – процессы, происходящие при постояннм занчении одного из параметров
Уравнения изопроцессов идеального газа:
1. T-const, PV-const, з-н Бойля-Мариотта
2. P-const, V/T-const, з-г Гей-Люссака
3. V-const, P/T-const, з-н Шарля
5.4. Внутренняя энергия - это энергия движения и взаимодействия частиц, из которых состоит тело
Способы изменения внутренней энергии: работа (деформация, трение); теплопередача (конвекция, теплопроводность, лучеиспускание).
Способы теплообмена:
Теплопроводность - передача энергии от одной части тела к другой
Конвекция - переноса тепловой энергии путем перемещения частиц жидкости или газа
Тепловое излучение - переноса тепловой энергии электромагнитными волнами
Количество теплоты – это энергия, которую тело теряет или приобретает при теплопередаче.
I-й закон термодинамики: 
5.5. Работа газа: A = p (V 2 – V 1) = p Δ V
Теплоёмкость, C — физ. величина, определяемая отношением бесконечно малого количества теплоты δ Q, полученного телом, к соответствующему приращению его температуры δ T

Способы изменения внутренней энергии: работа (деформация, трение); теплопередача (конвекция, теплопроводность, лучеиспускание).
I-й закон термодинамики при изопроцессах:
1. В изохорном процессе (V = const) газ работы не совершает, A = 0. Q = ΔU = U (T2) – U (T1)
2. В изобарном процессе (p = const) работа, совершаемая газом, выражается соотношением A = p Δ V
3. В изотермическом процессе температура газа не изменяется, следовательно, не изменяется и внутренняя энергия газа, Δ U = 0. Q = A
4. В адиабатическом процессе Q = 0. A = –ΔU
5.6. Количество теплоты – это энергия, которую тело теряет или приобретает при теплопередаче.
Теплоёмкость, C — физ. величина, определяемая отношением бесконечно малого количества теплоты δ Q, полученного телом, к соответствующему приращению его температуры δ T

Числом степеней свободы тела - число независимых координат, которые полностью определяют положение тела в пространстве
В однородном газе, молекулы которого имеют любое число степеней свободы i, каждая молекула в среднем обладает энергией движения, равной
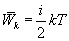 Теплоемкость при изопроцессах:
1. В адиабатическом процессе теплообмена с окружающей средой не происходит, то есть dQ=0. Однако, объём, давление и температура меняются, то есть
Теплоемкость при изопроцессах:
1. В адиабатическом процессе теплообмена с окружающей средой не происходит, то есть dQ=0. Однако, объём, давление и температура меняются, то есть 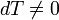
|

2. В изотермическом процессе T-const, то есть  . При изменении объёма газу передаётся (или отбирается) некоторое количество тепла.:
. При изменении объёма газу передаётся (или отбирается) некоторое количество тепла.:  (+- ∞)
(+- ∞)
3. В изохорном процессе V-const, то есть 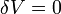 . Элементарная работа газа равна произведению изменения объёма на давление, при котором происходит изменение (
. Элементарная работа газа равна произведению изменения объёма на давление, при котором происходит изменение ( ). Первое Начало Термодинамики для изохорного процесса имеет вид:
). Первое Начало Термодинамики для изохорного процесса имеет вид:  А для идеального газа:
А для идеального газа: 

 , где γ — показатель адиабаты, R — универсальная газовая постоянная
, где γ — показатель адиабаты, R — универсальная газовая постоянная
4. В изобарном: Молярная теплоёмкость при постоянном давлении обозначается как  . В идеальном газе она связана с теплоёмкостью при постоянном объёме соотношением Майера
. В идеальном газе она связана с теплоёмкостью при постоянном объёме соотношением Майера 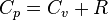 .
.
· для одноатомных газов 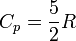
· для двухатомных газов 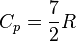
· для многоатомных газов 
5.7. Круговые процессы – если в результате изменений система вернулась в исходное состояние
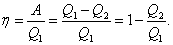 Работа, совершаемая за цикл, определяется площадью, охваченной замкнутой кривой.
Работа, совершаемая за цикл, определяется площадью, охваченной замкнутой кривой. 

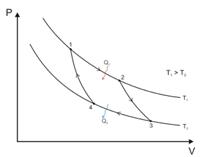
Цикл Карно — круговой процесс, состоящий из двух изотерм и двух адиабат.
5.9. Вязкость ( внутреннее трение) — одно из явлений переноса, свойство текучих тел (жидкостей и газов) оказывать сопротивление перемещению одной их части относительно другой.
Основной закон вязкого течения Ньютона: так сила внутреннего трения, проявляющаяся при перемещении одного слоя жидкости относительно другого, прямо пропорциональна градиенту относительной скорости этого перемещения и поверхности слоев.F=ηS 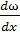 , где S – площадь слоя, ω – относительная скорость движения слоев, находящихся на расстоянии x, η – коэффициент вязкости (зависит от природы жидкости)
, где S – площадь слоя, ω – относительная скорость движения слоев, находящихся на расстоянии x, η – коэффициент вязкости (зависит от природы жидкости)
Вязкость газа. Сила вязкого трения возникает в результате взаимодействия двух слоев газа, движущихся с отличающимися друг от друга скоростями. Эта сила в соответствии со вторым законом Ньютона численно равна величине импульса K, передаваемого в единицу времени от слоя к слою через поверхность S. Значение K должно быть непосредственно связано с величиной du / dx, показывающей, как быстро меняется макроскопическая скорость газа u в направлении, перпендикулярном к направлению движения слоев газа.

5.10. Теплопроводность – способность материальных тел к переносу энергии (теплообмену) от более нагретых частей тела к менее нагретым телам, осуществляемому хаотически движущимися частицами тела
З-н Фурье: во всякой точке тела (вещества) в процессе теплопроводности присуща однозначная взаимосвязь между тепловым потоком и градиентом температуры
Q= - λ grad(T) S
где Q – тепловой поток, выражается в Вт;
grad(T) – градиент температурного поля (совокупности числовых значений температуры в разнообразных местах системы в выбранный момент времени), единицы измерения К/м;
S – площадь поверхности теплообмена, м2;
λ – коэффициент теплопроводности, Вт/(м К).
5.8. Обратимые и необратимые процессы, пути изменения состояния термодинамической системы. Процесс называют обратимым, если он допускает возвращение рассматриваемой системы из конечного состояния в исходное через ту же последовательность промежуточных состояний, что и в прямом процессе, но проходимую в обратном порядке. При этом в исходное состояние возвращается не только система, но и среда. Обратимый процесс возможен, если и в системе, и в окружающей среде он протекает равновесно. При этом предполагается, что равновесие существует между отдельными частями рассматриваемой системы и на границе с окружающей средой. Обратимый процесс - идеализированный случай, достижимый лишь при бесконечно медленном изменении термодинамических параметров. Скорость установления равновесия должна быть больше, чем скорость рассматриваемого процесса. Если невозможно найти способ вернуть и систему, и тела в окружающей среде в исходное состояние, процесс изменения состояния системы называют необратимым.
Необратимые процессы могут протекать самопроизвольно только в одном направлении; таковы диффузия,теплопроводность, вязкое течение и другое.
Примеры:
1.При диффузии выравнивание концентраций происходит самопроизвольно. Обратный же процесс сам по себе никогда не пойдет: никогда самопроизвольно смесь газов, например, не разделится на составляющие ее компоненты. Следовательно, диффузия — необратимый процесс.
2.Теплообмен, как показывает опыт, также является односторонне направленным процессом. В результате теплообмена энергия передается сама по себе всегда от тела с более высокой температурой к телу с более низкой температурой. Обратный процесс передачи теплоты от холодного тела к горячему сам по себе никогда не происходит.
3.Необратимым является также процесс превращения механической энергии во внутреннюю при неупругом ударе или при трении.
Между тем из первого закона термодинамики направленность и тем самым необратимость тепловых процессов не вытекает. Первый закон термодинамики требует лишь, чтобы количество теплоты, отданное одним телом, в точности равнялось количеству теплоты, которое получит другое. А вот вопрос о том, от какого тела, от горячего к холодному или наоборот, перейдет энергия, остается открытым.
Направленность реальных тепловых процессов определяется вторым законом термодинамики, который был установлен непосредственным обобщением опытных фактов. Это постулат. Немецкий ученый Р. Клаузиус дал такую формулировку второго закона термодинамики: невозможно перевести тепло от более холодной системы к более горячей при отсутствии других одновременных изменений в обеих системах или окружающих телах.
Из второго закона термодинамики вытекает невозможность создания вечного двигателя второго рода, т.е. двигателя, который бы совершал работу за счет охлаждения какого-либоодного тел
Изменение энтропии термодинамической системы при обратимом процессе как отношение общегоколичества тепла 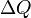 к величинеабсолютной температуры
к величинеабсолютной температуры  (то есть тепло, переданное системе, при постоянной температуре): ∆S=∆Q/∆T
(то есть тепло, переданное системе, при постоянной температуре): ∆S=∆Q/∆T
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
Второе начало термодинамики гласит, что невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому.
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не может равняться абсолютному нулю.