Зависимость ЭДС от активностей участвующих компонентов
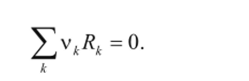 Рассмотрим гальванический элемент, в котором при постоянном давлении и температуре протекает окислительно-восстановительная реакция
Рассмотрим гальванический элемент, в котором при постоянном давлении и температуре протекает окислительно-восстановительная реакция
 Реакция протекает самопроизвольно за счет убыли энергии Гиббса, причем справедливо соотношение
Реакция протекает самопроизвольно за счет убыли энергии Гиббса, причем справедливо соотношение
где первое отношение — дифференциальное мольное изменение энергии Гиббса за счет протекания химической реакции; А — электрическая работа; z — число электронов, участвующих в электродной реакции, протекающей в гальваническом элементе; F — число Фарадея, равное 96 485 Кл/моль; Е — электродвижущая сила гальванического элемента.
Таким образом, для обратимого элемента его ЭДС может служить мерой изменения энергии Гиббса реакции, совершающейся в элементе.
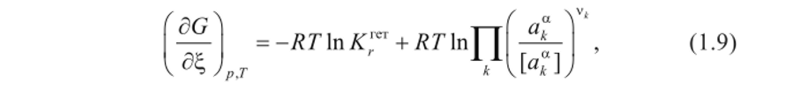 Запишем уравнение изотермы реакции Вант-Гоффа для данной реакции:
Запишем уравнение изотермы реакции Вант-Гоффа для данной реакции:
где К ™— константа равновесия гетерогенной реакции; а “— произвольно заданные активности компонентов в фазе а; [а“] — размерность активности компонента в фазе а.
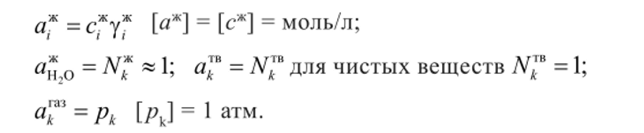 Уравнение (1.9) можно также записать в виде
Уравнение (1.9) можно также записать в виде
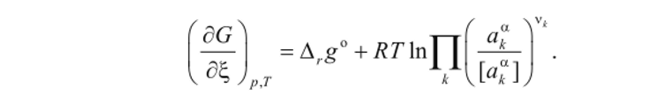
Активности компонентов, находящихся в разных фазах, выражаются в разных концентрационных шкалах:
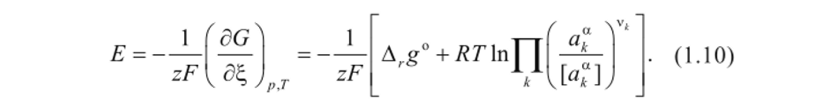 Теперь можно выразить ЭДС элемента с учетом активностей компонентов реакции:
Теперь можно выразить ЭДС элемента с учетом активностей компонентов реакции:
Если активности компонентов равны единице, то получим стандартную ЭДС гальванического элемента (зависящую от природы электродов и температуры)

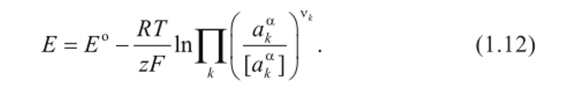 с учетом которой уравнение (1.9) можно представить в виде:
с учетом которой уравнение (1.9) можно представить в виде:
Уравнение (1.12) называют уравнением Нернста. Далее для простоты условно опустим из записи уравнений обозначение размерностей, понимая, что всякий раз под логарифмом стоит безразмерная величина.
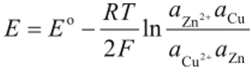 Для рассмотренного выше элемента Даниэля — Якоби уравнение (1.12) запишется так:
Для рассмотренного выше элемента Даниэля — Якоби уравнение (1.12) запишется так:
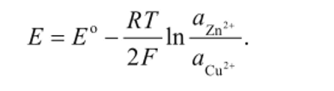 Активности чистых металлов (меди и цинка) в А-шкале равны 1,
Активности чистых металлов (меди и цинка) в А-шкале равны 1,
поэтому
По источнику ЭДС гальванические элементы делятся на химические и концентрационные.
В химических гальванических элементах источником ЭДС является химическая реакция. В концентрационных элементах ЭДС возникает за счет разной концентрации ионов в растворах и вещества на электродах.
И химические, и концентрационные гальванические элементы по наличию или отсутствию диффузионной разности потенциалов (д,1 ср) делятся на элементы с переносом и элементы без переноса. В данной курсовой работе будут исследоваться только химические гальванические элементы без переноса.
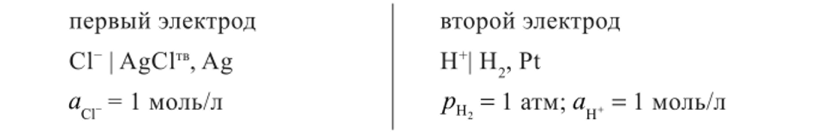 Рассмотрим, например, как правильно составить схему гальванического элемента без переноса из двух электродов:
Рассмотрим, например, как правильно составить схему гальванического элемента без переноса из двух электродов:
Слева в схеме гальванического элемента должен располагаться электрод, обладающий более отрицательным электродным потенциалом, а справа — более положительным. Логично поэтому сравнить стандартные электродные потенциалы указанных электродов и выяснить, какой электрод в какой части гальванического элемента будет расположен. Электродные потенциалы в таблицах сгруппированы по типам электродов, поэтому необходимо определить, к каким типам эти электроды относятся. Очевидно, что первый из указанных электродов — это электрод второго рода (хлорсеребряный), а второй электрод - газовый (водородный).
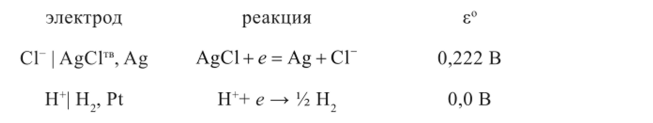 Выпишем из справочника электродные реакции и значения стандартных электродных потенциалов:
Выпишем из справочника электродные реакции и значения стандартных электродных потенциалов:
Судя по значению стандартных электродных потенциалов, слева будет расположен водородный электрод, справа — хлорсеребряный (рис. 1.4). Поскольку по заданию гальванический элемент должен быть без переноса, то электролитом будет такой раствор, в котором катион совпадает с катионом водородного электрода, а анион — с анионом хлорсеребряного электрода. Таким раствором может быть только раствор хлористого водорода.
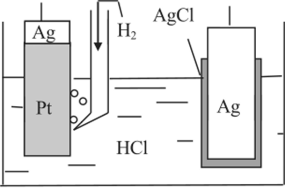 Рис. 1.4
Рис. 1.4
Запишем схему гальванического элемента
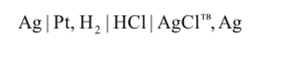
На концах данного гальванического элемента расположен один и тот же металл, т. е. это правильно разомкнутый гальванический элемент.
При записи реакции на электродах необходимо помнить, что катодная реакция пишется так же, как она приведена в справочнике, а анодная реакция — как реакция окисления, т. е. формально берется реакция из справочника и меняются местами правая и левая части уравнения.
Катодная реакция: AgCl + e = Ag + СГ
Анодная реакция: 0,5Н2 = Н+ + ё
Итоговая реакция: AgCl + 0,5H2 = Ag + Н+ +СГ (1.13)
Используем формулу (1.12) для выражения зависимости электродвижущей силы этого гальванического элемента от концентрации электролита.
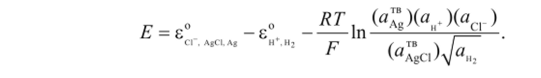
Активности чистого серебра и чистого хлористого серебра в V-шкале равны 1, активность газообразного водорода выражается в шкале, т. е. уравнение принимает вид
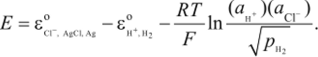
При переходе от активности к концентрациям (при р = 1 атм) получаем
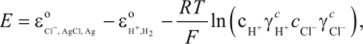
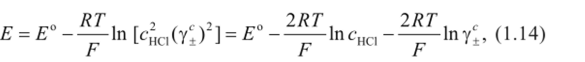
где с — концентрация раствора электролита, моль/л; ус± — средний ионный коэффициент активности раствора электролита, выраженный в с-шкале.
 Рассмотрим еще один пример. Пусть нужно составить гальванический элемент из таких электродов:
Рассмотрим еще один пример. Пусть нужно составить гальванический элемент из таких электродов:
Первый электрод относится к электродам первого рода, второй — к электродам второго рода.
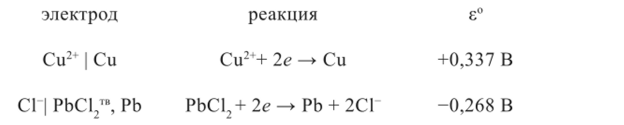 Выписываем из справочника реакции и значения стандартных электродных потенциалов:
Выписываем из справочника реакции и значения стандартных электродных потенциалов:
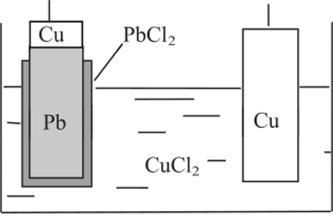 Судя по значению стандартных электродных потенциалов, слева в нашем гальваническом элементе будет расположен хлор- свинцовый электрод, а справа — медный электрод. Электролитом нашего гальванического элемента без переноса должен быть раствор, в котором катион такой же, как в электроде первого рода, а анион — такой же, как анион в электроде второго рода, т. е. электролитом может быть только раствор хлорида двухвалентной меди (рис. 1.5), а схема правильно разомкнутого гальванического элемента будет такой:
Судя по значению стандартных электродных потенциалов, слева в нашем гальваническом элементе будет расположен хлор- свинцовый электрод, а справа — медный электрод. Электролитом нашего гальванического элемента без переноса должен быть раствор, в котором катион такой же, как в электроде первого рода, а анион — такой же, как анион в электроде второго рода, т. е. электролитом может быть только раствор хлорида двухвалентной меди (рис. 1.5), а схема правильно разомкнутого гальванического элемента будет такой:
 Рис. 1.5
Рис. 1.5
Уравнение Нернста для ЭДС данного гальванического элемента:
 В соответствии с уравнением диссоциации соли СuС12 при концентрации хлорида меди, равной с, концентрации ионов будут следующими: = с; с -2с. С учетом этого получим уравнение Нернста
В соответствии с уравнением диссоциации соли СuС12 при концентрации хлорида меди, равной с, концентрации ионов будут следующими: = с; с -2с. С учетом этого получим уравнение Нернста
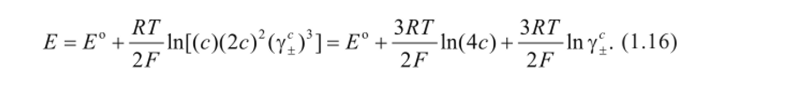
Конечно, уравнения для расчета ЭДС будут различными в зависимости от природы электродов, составляющих гальванический элемент, и числа электронов, участвующих в итоговой реакции.
Заключение
Для написания курсовой подобрана тематическая литература о об электрохимии цепей, которая дает исчерпывающую информацию по требуемому вопросу. Тема работы актуальная и оригинальная.
При написании работы, опора была сделана на том, что в электрохимической
лаборатории проводят физико-химические реакции с измерением электродвижущей силы гальванических элементов. Поэтому любому химику необходимо разбираться в установках и процессах электрической химии.
Следует подчеркнуть, что в лаборатории э.д.с обычно измеряют потенциометром с точностью до 0,2мВ (милливольт). Это делается для того, чтобы определить направление процесса и выход реакции. Также можно узнать среду электролита, растворимость трудно растворимой соли и значения термодинамических величин.
Таким образом, электродвижущая сила является важнейшей мерой
работы гальванического элемента (производителя тока), с чем не стоит путать процессы электролизера (потребителя тока).
Список литературы поправь
1. Герасимов В.П. Формальная кинетика. М.:Химия. 1973. - С.488-495.
2. Стромберг А.Г., Семченко Д.П. // Учеб. для вузов 2001. 5-е изд.исправлен. С. 247.
3. Зависимость ЭДС гальванического // Studme - учебные материалы для студентов © 2013 - 2018 [Электронный ресурс]. режим доступа: https://studme.org/222631/matematika_himiya_fizik/zavisimost_galvanicheskogo_elementa_aktivnostey_komponentov_uchastvuyuschih_reaktsii (дата обращения: 25.12.18).
4. Лекции Сафаровой И.В. Применение ЭДС//БашГУ. -2018. – С.124
5. Электронная библиотека БашГУ Практикум по электрохимии. – С.57 [Электронныйресурс]. - Режим доступа:
https://elib.bashedu.ru/dl/read/Zimin_Borisov_Hursan_Praktikum%20po%20elektrohimii_up_2011.pdf/view (дата обращения: 21.12.18).