Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
Все реакции можно разделить на гетеро- и гомогенные. Гетерогенные реакции (греч. heterogenes - разнородный) - реакции, протекающие на границе раздела фаз, в неоднородной среде. Скорость таких реакций зависит от площади соприкосновения реагирующих веществ.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
Zn(тв.) + 2HCl(р-р.) = ZnCl2(р-р.) + H2(газ.)↑

Гомогенные реакции (греч. homogenes - однородный) - реакции, протекающие между веществами, находящимися в одной фазе.
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
NaOH(р-р.) + CH3COOH(р-р.) = CH3COONa(р-р.) + H2O(р-р.)

Реакции и их тепловой эффект
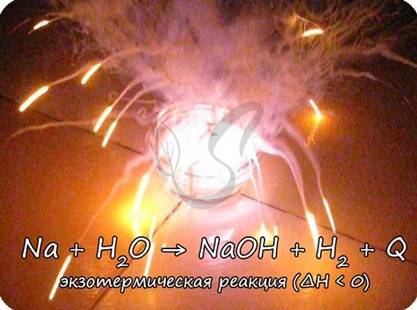
Все реакции можно разделить на те, в ходе которых тепло поглощается, или, наоборот, тепло выделяется. Представьте пробирку, охлаждающуюся или нагревающуюся в вашей руке - это и есть тот самый тепловой эффект. Иногда тепла выделяется так много, что реакции сопровождаются воспламенением или взрывом (натрий с водой).
Экзотермические реакции
Экзотермические реакции (греч. exo - вне) - химические реакции, сопровождающиеся потерей энергии системой и выделением тепла (той самой энергии) во внешнюю среду. При написании химических реакций в конце экзотермических ставят "+ Q" (Q - тепло), иногда бывает указано точное количество выделяющегося тепла. Например:
2Mg + O2 = 2MgO + Q
NaOH + HCl = NaCl + H2O + 56 кДж

К экзотермическим реакциям часто относятся реакции горения, соединения.
4NH3 + 5O2 = 4NO + 6H2O + Q
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
N2 + O2 ⇄ 2NO - Q
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью "запутывания" в реакции вместо явного +Q при экзотермической реакции могут написать ΔH < 0. Например:
2Na + 2H2O = 2NaOH + H2; ΔH < 0 (это значит, что тепло выделяется - реакция экзотермическая)
Эндотермические реакции
Эндотермические реакции (греч.ἔνδον - внутри) - химические реакции, сопровождающиеся поглощением тепла, в результате которых образуются вещества с более высоким энергетическим уровнем (их внутренняя энергия увеличивается).
К таким реакциям наиболее часто относятся реакции разложения. При написании эндотермических реакций в конце ставят "-Q", либо указывают точное количество поглощенной энергии. Примеры таких реакций:
2HgO = Hg + O2 - Q
CaCO3 = CaO + CO2↑ - Q
С целью "запутывания" может быть дана энтальпия, она при таких реакциях всегда: ΔH > 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)

Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония ("вулканчик") является примером экзотермического разложения, при котором тепло выделяется.

Домашнее задание
1. Повторить названия и написание химических элементов