МНОГОВАРИАНТНЫЕ РАСЧЕТНЫЕ ЗАДАНИЯ
1.1. На основании значений теплот образования веществ  из справочника [3] определите изобарный тепловой эффект химической реакции А (табл. 10) QP =
из справочника [3] определите изобарный тепловой эффект химической реакции А (табл. 10) QP =  (в кДж) при условии, что все вещества, участвующие в реакции, находятся в идеальном газообразном состоянии.
(в кДж) при условии, что все вещества, участвующие в реакции, находятся в идеальном газообразном состоянии.
1.2. Определите изменение числа молей газообразных веществ реакции А при 298 К и стандартном давлении.
1.3. Рассчитайте работу (в кДж), совершаемую в реакции А против внешнего давления при P = const и T = 298 K.
1.4. Определите изохорный тепловой эффект химической реакции А QV =  при условии, что все вещества, участвующие в реакции, находятся в идеальном газообразном состоянии.
при условии, что все вещества, участвующие в реакции, находятся в идеальном газообразном состоянии.
1.5. На основании данных из справочника [3] определите изменение средней теплоемкости в системе в результате реакции А  (в Дж/К). Температуру Т для своего варианта возьмите из табл. 10.
(в Дж/К). Температуру Т для своего варианта возьмите из табл. 10.
1.6. Определите тепловой эффект реакции А при температуре T и стандартном давлении 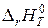 (в кДж), используя найденные ранее значения
(в кДж), используя найденные ранее значения 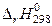 и
и  .
.
1.7. Установите, как будет меняться тепловой эффект химической реакции А при повышении температуры. Ответ аргументируйте, используя соответствующие уравнения химической термодинамики.
1.8. Определите изменение энтропии системы (в Дж/К) в результате химической реакции А (табл. 10), протекающей между веществами в идеальном газообразном состоянии при стандартном давлении и температуре 298 К. Значения стандартной энтропии для веществ возьмите из справочника [3].
1.9. Рассчитайте изменение энтропии  (в Дж/К) в результате реакции А при температуре Т и стандартном давлении, используя рассчитанные в п. 1.8. значения изменения энтропии при температуре 298 К и
(в Дж/К) в результате реакции А при температуре Т и стандартном давлении, используя рассчитанные в п. 1.8. значения изменения энтропии при температуре 298 К и  .
.
1.10. Определите изменение стандартной энергии Гиббса  (Дж) для химической реакции А при температуре 298 К и при температуре Т.
(Дж) для химической реакции А при температуре 298 К и при температуре Т.
1.11. Рассчитайте термодинамическую константу равновесия Ka реакции А при температуре 298 К и температуре Т.
1.12. Определите глубину превращения ξ в реакции A при температуре Т и атмосферном давлении при условии, что исходные вещества взяты в стехиометрических количествах.
1.13. Определите глубину превращения ξ в реакции A при температуре Т и атмосферном давлении при условии, что исходные вещества взяты в количествах, указанных в табл. 11.
1.14. Определите степень превращения исходных веществ при условиях 1.12 и 1.13.
1.15. Определите состав равновесной смеси в %(мол.) для химической реакции А при температуре Т и атмосферном давлении при условиях 1.12 и 1.13.
1.16. Установите, как влияет повышение температуры на термодинамическую константу равновесия Ka и равновесный выход продуктов химической реакции А. Ответ аргументируйте, используя соответствующие уравнения химической термодинамики. Сопоставьте сделанные выводы с расчетными значениями констант равновесия.
1.17. Установите, как влияет повышение общего давления на равновесный выход продуктов химической реакции А. Ответ аргументируйте.
1.18. Сделайте вывод об оптимальных условиях протекания процесса: при каких температурах и давлениях следует проводить реакцию А для получения максимального выхода продуктов. При ответе на данный вопрос учитывайте кинетические факторы и энергетические и экономические затраты.
Таблица 1.1.
| Вариант | Химическая реакция А | Т, К | 
|
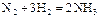
| 0.11 | ||

| 1.73∙1030 | ||

| 5.26∙109 | ||

| 4.48∙106 | ||

| 4.79∙103 | ||

| 1.73∙104 | ||

| 90.29 | ||

| 4.67∙102 | ||

| 8.11∙109 | ||

| 1.23∙106 | ||
| 2HBr = H2 + Br2 | 1.8∙10-9 | ||
| 2HI = H2 + I2 | 7.75∙10-3 | ||
| 2CO +S2 = COS | 3.56∙1011 | ||
| CH3OH + H2 = CH4 + H2O | 1.97∙1012 | ||
| 2H2O = 2H2 + O2 | 6.61∙10-32 | ||
| (CH2)2O + H2 = C2H5OH | 3.38∙104 | ||
| CO + H2O = CO2 + H2 | 1.39∙102 | ||
| 3H2 + CO2 = CH3OH + H2O | 2.2∙10-7 | ||
| 2N2O = 2N2 + O2 | 1.12∙1022 | ||
| N2 + O2 = 2NO | 6.01∙10-9 | ||
| 2H2S = 2H2 + S2 | 2.13∙10-7 | ||
| 2CH4 = C2H2 + 3H2 | 5.25∙10-13 | ||
| CO + 2H2 = CH3OH | 1.31∙10-4 | ||
| 2NO + O2 = 2NO2 | 6.02 | ||
| 2SO2 + O2 = 2SO3 | 2.65∙107 | ||
| 2CO + 2H2 = CH4 + CO2 | 2.01∙102 |
Таблица 1.2.
| Вариант | Начальное количество исходных веществ |
| N2 – 0,2 моль; H2 – 2,0 моль | |
| CCl4 – 5,0 моль; H2 – 10,0 моль | |
| CH4 – 0,02 моль; S2 – 0,1 моль | |
| H2 – 0,05 моль; CCl4 – 1,0 моль | |
| CO – 0,02 моль; H2 – 1,0 моль | |
| Cl2 – 0,5 моль; CO – 5,0 моль | |
| CH3I – 0,3 моль; HI – 3,0 моль | |
| CH4 – 0,2 моль; Br2 – 2,0 моль | |
| F2 – 0,8 моль; Н2O – 4,0 моль | |
| CH4 – 1,0 моль; Cl2 – 10,0 моль | |
| HBr – 0,2 моль; – | |
| HI – 0,3 моль; – | |
| O2 – 0,2 моль; S2 – 2,0 моль | |
| CH3OH – 0,6 моль; H2 – 6,0 моль | |
| Н2О – 0,1 моль; – | |
| СН3СНО – 1,0 моль; Н2 – 10,0 моль | |
СО – 0,3 моль; Н2О –  3,0 моль 3,0 моль
| |
| Н2 – 0,1 моль; СО2 – 1,0 моль | |
| N2O – 0,1 моль; – | |
| N2 – 1,0 моль; О2 – 10,0 моль | |
| H2S – 1,0 моль; – | |
| СН4 – 0,1 моль; – | |
| СО – 0,1 моль; Н2 – 10,0 моль | |
| NO – 1,0 моль; О2 – 5,0 моль | |
| SO2 – 0,2 моль; О2 – 1,0 моль | |
| СО – 0,1 моль; Н2 – 1,0 моль |