Изохорный процесс
Уравнение изохорного процесса: 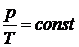 .
.
Выражения для расчета:
- работы изменения объема  ;
;
- количества теплоты 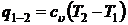 ;
;
- изменения внутренней энергии  ;
;
- изменения энтальпии  ;
;
- изменения энтропии  ;
;
Теплоемкость: с = сu.
Графики процесса в рu и Ts – диаграммах представлены на рис 1. Схема распределения энергии в изохорном процессе представлена на рис. 2.

Рис. 1. Графики термодинамического процесса при u = const.

Изобарный процесс
Уравнение изобарного процесса:  .
.
Выражения для расчета:
- работы изменения объема 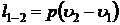 ;
;
- количества теплоты 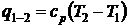 ;
;
- изменения внутренней энергии 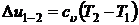 ;
;
- изменения энтальпии  ;
;
- изменения энтропии  .
.
Теплоемкость: с = ср = сu + R.
Графики процесса в рu и Ts – диаграммах представлены на рис 3. Схема распределения энергии в изобарном процессе представлена на рис. 4.
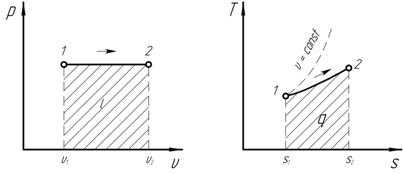
Рис. 3. Графики термодинамического процесса при p = const.

Изотермический процесс
Уравнение изотермического процесса: pu = const.
Выражения для расчета:
- работы изменения объема 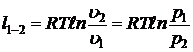 ;
;
- количества теплоты  ;
;
- изменения внутренней энергии D u 1-2 = 0;
- изменения энтальпии D h 1-2 = 0;
- изменения энтропии 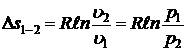 .
.
Теплоемкость: с = ¥.
Графики процесса в рu и Ts – диаграммах представлены на рис 5. Схема распределения энергии в изотермическом процессе представлена на рис. 6.

Рис. 5. Графики термодинамического процесса при T = const.

Адиабатный процесс
Уравнение адиабатного процесса: 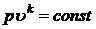 .
.
Соотношения между основными параметрами в адиабатном процессе:
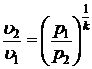 ;
; 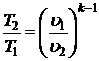 ;
;  .
.
Выражения для расчета:
- работы изменения объема
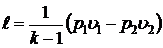 ; ;
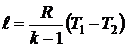
| 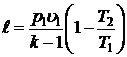
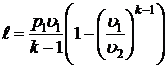 ; ;
 ; ;
|
- количества теплоты q 1-2 = 0;
- изменения внутренней энергии 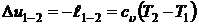 ;
;
- изменения энтальпии 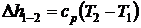 ;
;
- изменения энтропии  .
.
Теплоемкость: с = 0.
Графики процесса в рu и Ts – диаграммах представлены на рис 7. Схема распределения энергии в адиабатном процессе представлена на рис. 8.

Рис. 7. Графики термодинамического процесса при s = const.
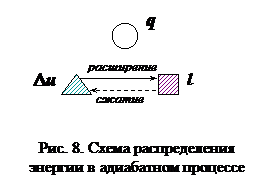
Политропный процесс
Уравнение политропного процесса:  ,
,
где 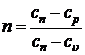 – постоянная величина, называемая показателем политропы.
– постоянная величина, называемая показателем политропы.
Соотношения между основными параметрами в политропном процессе:
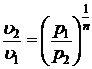 ;
; 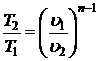 ;
; 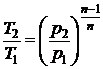 .
.
Выражения для расчета:
- работы изменения объема
 ; ;

| 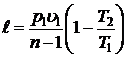
 ; ;
 ; ;
|
- количества теплоты q 1-2 = cn (T2 – T1);
- изменения внутренней энергии 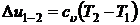 ;
;
- изменения энтальпии 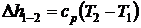 ;
;
- изменения энтропии 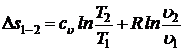 .
.
Теплоемкость:  .
.
Политропных процессов существует бесчисленное множество, так как  и
и  .
.
В таблице 1 представлены характеристики каждого процесса. При составлении этой таблицы было принято, что количество рабочего тела равно 1 кг, теплоемкость газа постоянна и четыре основных термодинамических процесса являются частными случаями политропного при соответствующих значениях n.
Таблица 1. Характеристики основных термодинамических процессов идеального газа
| № п.п. | Характеристика процесса | Наименование процесса | ||||
| изохорный | изобарный | изотермический | адиабатный | политропный | ||
| Показатель политропы | ¥ | 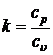
| 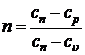
| |||
| Уравнение процесса | 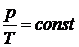
| 
| pu = const | puk = const | pun = const | |
| Теплоемкость, кДж/(кг×К) | cu | cp = cu + R | ¥ | 
| ||
Изменение внутренней энергии 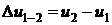 , кДж/кг , кДж/кг
| cu (T2 – T1) | cu (T2 – T1) | cu (T2 – T1) | cu (T2 – T1) | ||
Изменение энтальпии 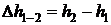 , кДж/кг , кДж/кг
| cp (T2 – T1) | cp (T2 – T1) | cp (T2 – T1) | cp (T2 – T1) | ||
| Количество теплоты q 1-2, кДж/кг | cu (T2 – T1) | cp (T2 – T1) | 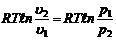
| cn (T2 – T1) | ||
| Работа изменения объема l 1-2, кДж/кг | p (u2 – u1) = = R (T2 – T1) | 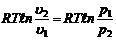
| 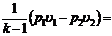
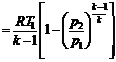
| 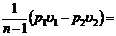
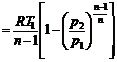
|
Примеры решения задач
Задача 1. В закрытом сосуде емкостью V = 0,6 м3 содержится азот при давлении р1 = 0,5 МПа и температуре t1 = 20 °C. В результате охлаждения сосуда азот, содержащийся в нем, теряет 105 кДж теплоты. Принимая теплоемкость азота постоянной, определить, какие давление и температура (°C) устанавливаются в сосуде после охлаждения.
Решение.
Количество отводимой теплоты равно:
– Q = mcu (t2 – t1).
Откуда следует, что температура азота после охлаждения будет равна:
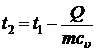 .
.
Массу азота определим из уравнения Клапейрона:
 Þ
Þ 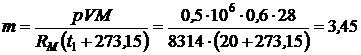 кг.
кг.
Массовая теплоемкость азота при постоянном объеме определяется как для двухатомного газа. По Приложению 1 ПЗ 4 сuМ = 20,93 кДж/(кмоль×К):
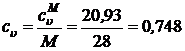 кДж/(кг×К).
кДж/(кг×К).
Тогда 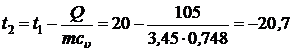 °C.
°C.
Так как азот охлаждался в емкости с постоянным объемом, то давление азота после охлаждения определим из уравнения для изохорного процесса:
 Þ
Þ  МПа.
МПа.
Ответ: t2 = – 20,7 °C, р2 = 0,43 МПа.
Задача 2. В установке воздушного отопления внешний воздух при t1 = – 15 °C нагревается в калорифере при р = const до 60 °C. Какое количество теплоты надо затратить для нагревания 1010 м3 наружного воздуха? Давление воздуха считать равным 755 мм рт.ст.
Решение.
Количество теплоты, подводимое к воздуху, будет равно:
Q = mcр (t2 – t1).
Массу воздуха определим из уравнения Клапейрона:
 Þ
Þ  кг.
кг.
Массовая теплоемкость воздуха при постоянном давлении определяется как для двухатомного газа. По Приложению 1 ПЗ 4 срМ = 29,31 кДж/(кмоль×К):
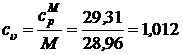 кДж/(кг×К).
кДж/(кг×К).
Тогда Q = mcр (t2 – t1) = 1372 × 1,012 × (60 – (–15) = 104,2 МДж.
Ответ: Q = 104,2 МДж.
Задача 3. 25 кг воздуха при t = 27 °C изотермически сжимаются до тех пор, пока давление не становится равным 4,15 МПа. На сжатие затрачивается работа L = – 8,0 МДж. Найдите начальное давление и объем, конечный объем и теплоту, отведенную от воздуха.
Решение.
Так как при изотермическом процессе D U = 0, то Q = L = – 8,0 МДж.
Начальное давление определим из выражения по определению количества теплоты для изотермического процесса:
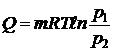 Þ
Þ 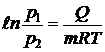 .
.
Подставив в полученную формулу 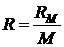 , окончательно получим:
, окончательно получим:
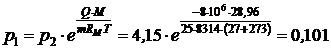 МПа.
МПа.
Начальный объем определим из уравнения Клапейрона:
 Þ
Þ 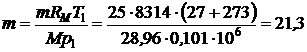 м3.
м3.
Конечный объем определим из уравнения изотермического процесса:
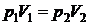 Þ
Þ  м3.
м3.
Ответ: р 1 = 0,101 МПа, V 1 = 21,3 м3, V 2 = 0,518 м3, Q = – 8,0 МДж.
Задача 4. В двигателе Дизеля топливо, впрыскиваемое в цилиндр, самовоспламеняется при соприкосновении со сжатым воздухом, имеющим температуру большую, чем температура воспламенения топлива.
Определите минимальную необходимую степень сжатия e = u 1/ u 2 и давление в конце сжатия р2, если температура воспламенения топлива равна 630 °C. Перед началом сжатия воздух в цилиндре имеет параметры р 1 = 0,097 МПа, t1 = 60 °C. Сжатие считать адиабатным. Задачу решить, не учитывая зависимости теплоемкости от температуры и принимая k = 1,40.
Решение.
Давление в конце сжатия определим из уравнения адиабатного процесса:
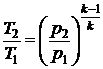 Þ
Þ 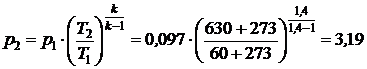 МПа.
МПа.
Отношение u 1/ u 2, то есть степень сжатия e определим из другого уравнения адиабатного процесса:
 Þ
Þ 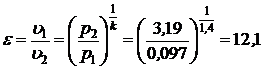 .
.
Ответ: р 2 = 3,19 МПа, e = 12,1.
Задача 5. Азот массой 1 кг в начальном состоянии имеет параметры р 1 = 2,5 МПа и t 1 = 700 °C. После политропного расширения (показатель политропы n = 1,18) его давление р 2 = 0,1 МПа. Определите изменение внутренней энергии D u 1-2, количество теплоты q 1-2, сообщенное азоту в процессе 1-2, и работу расширения l 1-2.
Решение.
Сначала определим температуру газа в конце процесса расширения:
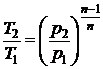 Þ
Þ 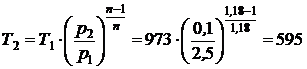 К.
К.
Изменение удельной внутренней энергии при совершении политропного процесса определяется по формуле:
D u 1-2 = cu (T2 – T1) = 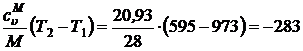 кДж/кг.
кДж/кг.
Удельное количество теплоты, сообщенное азоту в процессе 1-2, при совершении политропного процесса определяется по формуле:
q 1-2 = cn (T2 – T1) = 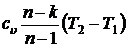 ,
,
где 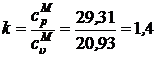 – показатель адиабаты для двухатомных газов.
– показатель адиабаты для двухатомных газов.
Тогда q 1-2 = 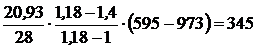 кДж/кг.
кДж/кг.
Удельная работа расширения при совершении политропного процесса определяется по формуле:
l 1-2 = 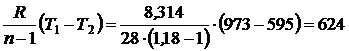 кДж/кг.
кДж/кг.
Проверку сделаем по уравнению первого закона термодинамики:
D u 1-2 = q 1-2 – l 1-2 = 345 – 624 = –279 » –283 кДж/кг, т.е. задача решена верно.
Ответ: D u 1-2 = –283 кДж/кг, q 1-2 = 345 кДж/кг, l 1-2 = 624 кДж/кг.
Задачи для самостоятельного решения
1. Азот в количестве 10 м3 (приведенный к нормальным условиям) заключили в герметичный сосуд и нагрели до температуры t1 = 1450 °С. Давление при этом стало равным 3,8 МПа. Затем газ охладили до температуры t2 = 47 °С. Каким стало давление после охлаждения и сколько теплоты отведено?
2. В цилиндре, площадь поперечного сечения которого равна 1 дм2, под поршнем находится 0,5 кмоля азота при t1 = 63 °С. Поршень находится под постоянной внешней нагрузкой F = 2 кН. Газу извне сообщается теплота Q = 6300 кДж, вследствие чего она расширяется, отодвигая поршень.
Определите параметры р, u, t в конце процесса, изменение внутренней энергии, изменение энтальпии и работу расширения, совершенную газом.
3. Азот с приведенным к нормальным условиям объемом Vн = 3,5 м3 находится в первоначальном состоянии при р1 = 0,11 МПа и t1 = 25°С. Его подвергают изотермическому сжатию до давления р2 = 2,4 МПа.
Найдите удельные объемы в начальном и конечном состояниях, работу, затраченную на сжатие, и теплоту, отведенную от газа.
4. Азот из баллона емкостью 0,05 м3 выпускается в атмосферу настолько быстро, что теплообмен между ней и азотом в баллоне не успевает совершится. До выпуска давление в баллоне было р1 = 1,2МПа и температура t1 = 27°С. После закрытия вентиля температура в баллоне стала t2 = 0°С. Какова масса выпущенного азота и каким стало давление в баллоне после выпуска?
5. Поршневой компрессор (в условиях, приведенных к нормальным условиям) производительностью Vtн = 2100 м3/ч засасывает воздух, параметры которого р1 = 0,1 МПа t1 = 25°С, и сжимает его до р2 = 0,9 МПа. Процесс сжатия политропный, с показателем политропы n = 1,2.
Определите, какое количество воды в час нужно пропустить через охлаждающую рубашку цилиндра, если вода нагревается на D t = 15°С.