Тема. Алкены.
Записать в тетрадь все, что выделено зеленым.
 Алкены, или олефины, этиленовые — непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна двойная связь. Алкены содержат в своей молекуле меньшее число водородных атомов, чем соответствующие им алканы (с тем же числом углеродных атомов), поэтому такие углеводороды называют непредельными или ненасыщенными.
Алкены, или олефины, этиленовые — непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна двойная связь. Алкены содержат в своей молекуле меньшее число водородных атомов, чем соответствующие им алканы (с тем же числом углеродных атомов), поэтому такие углеводороды называют непредельными или ненасыщенными.
Первыми представителями гомологического ряда являются этилен (с двойной связью)
и ацетилен (с тройной связью).
 Как следует из электронного строения, кратные связи (двойные или тройные) сравнительно легче одинарных разрываются при химическом взаимодействии.
Как следует из электронного строения, кратные связи (двойные или тройные) сравнительно легче одинарных разрываются при химическом взаимодействии.
По систематической номенклатуре названия алкенов производят заменой суффикса -ан в соответствующих алканах на суффикс -ен (алкан — алкен, этан — этен, пропан — пропен и т.д.). Выбор главной цепи и порядок названия тот же, что и для алканов. Однако в состав цепи должна обязательно входить двойная связь. Нумерацию цепи начинают с того конца, к которому ближе расположена эта связь.
Алкены образуют гомологический ряд с общей формулой CnH2n .

Строение молекулы этилена
Простейшим представителем этиленовых углеводородов, его родоначальником является этилен (этен) С2Н4. Строение его молекулы можно выразить такими формулами:
H HHH
| |::
C==C C::C
| |::
H HHH
По названию первого представителя этого ряда такие углеводороды называют этиленовыми.
Атомы углерода в составе молекулы алкена связаны между собой двойной связью. Эти атомы находятся в состоянии sp2-гибридизации. Двойная связь между ними образована из двух пар обобществленных электронов, т.е. это четырехэлектронная связь. Она сочетанием ковалентных σ-связи и π-связи. σ-Связь образована за счет осевого перекрывания sp2-гибридных орбиталей, а π-связь – за счет бокового перекрывания негибридизованных p-орбителей двух атомов углерода.

Пять σ-связей двух sp2-гибридизованных атомов углерода лежат в одной плоскости под углом 120 и составляют σ-скелет молекулы. Над и под этой плоскостью симметрично расположена электронная плотность π-связи, которую можно изобразить также в виде плоскости, перпендикулярной σ-скелету.
При образовании π-связи происходит сближение атомов углерода, потому что межъядерное пространство в двойной связи более насыщено электронами, чем в σ-связи. Это стягивает атомные ядра и поэтому длина двойной связи (0,133 нм) меньше одинарной (0,154 нм).
Химические свойства алкенов.
Запомните! Реакции замещения свойственны алканам и высшим циклоалканам, имеющим только одинарные связи, реакции присоединения – алкенам, диенам и алкинам, имеющим двойные и тройные связи.
Этиленовые обладают большей химической активностью, чем предельные углеводороды.
Химические свойства алкенов определяются двойной углерод-углеродной связью. π-Связь, как наименее прочная и более доступная, при действии реагента разрывается, а освободившиеся валентности углеродных атомов затрачиваются на присоединение атомов, из которых состоит молекула реагента. Это можно представить в виде схемы:
\ π / \ /
C==C + A—B → C—C
/ σ \ / | σ | \
А В
Для алкенов характерны реакции присоединения, окисления, полимеризации.
Реакции присоединения. Чаще реакции присоединения идут по гетеролитическому типу, являясь реакциями электрофильного присоединения.
- Присоединение водорода (гидрирование) Эта реакция протекает в присутствии катализатора – мелко раздробленного никеля, платины или палладия – при комнатной температуре:
СН2=СН2 + H2 → СН3—СН3
- Присоединение галогенов (при обычных условиях):
СН2=СН2 + Cl2 → ClCH2—CH2Cl (дихлорэтан)
Дихлорэтан – жидкость, хорошо растворяет органические вещества.
СН2=СН2 + Br2 → Br CH2—CH2 Br (дибромэтан)
Легче идет присоединение хлора и брома, труднее — иода. Фтор с алкенами, как и с алканами, взаимодействует со взрывом. Присоединение брома к алкенам (реакция бромирования) — качественная реакция на непредельные углеводороды. При пропускании через бромную воду непредельных углеводородов желтая окраска исчезает.
- Присоединение галогеноводородов: СН2=СН2 + Н—Cl→ CH3—CH2Cl
Присоединение галогенводородов к гомологам этилена идет по правилу В.В.Марковникова: при обычных условиях водород галогенводорода присоединяется по месту двойной связи к наиболее гидрогенизированному атому углерода при двойной связи, а галоген — к менее гидрогенизированному.
СН3— СН = СН2 + НВr → CH3—CH— CH3
|
Вr
Реакция идет по ионному механизму.
Правило Марковникова соблюдается при присоединении к несимметричным алкенам и других электрофильных реагентов (H2O, H2SО4, НСl и др.).
- Присоединение воды (реакция гидратации). Эта реакция протекает в присутствии катализатора – серной кислоты:
CH2=CH2 + H2О → CH3—CH2OH
Реакции окисления. Алкены окисляются легче, чем алканы. Продукты, образованные при окислении алкенов, и их строение зависят от строения алкенов и от условий проведения реакции.
- Горение- полное окисление: Н2С=СН2 + 3O2 → 2СO2 + 2Н2O, горит красноватым пламенем, т.к. массовая доля углерода в алкенах больше, чем в алканах.
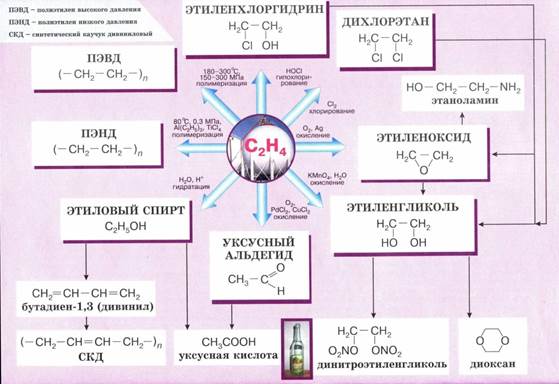
2. При действии на этилен водного раствора КМnO4 (при нормальных условиях) происходит образование двухатомного спирта — этиленгликоля - это неполное окисление: за счет разрыва π – связи ( в нейтральной или слабо щелочной среде действием раствора KMnO4)
3H2C=CH2 + 2KMnO4 + 4H2O → 3HOCH2—CH2OH + 2MnO2 + KOH
Эта реакция является качественной: фиолетовая окраска раствора перманганата калия изменяется при добавлении к нему непредельного соединения.
Этиленгликоль используется в качестве антифриза, из него получают волокно лавсан, взрывчатые вещества.
В более жестких условиях (окисление КМnO4 в присутствии серной кислоты или хромовой смесью) в алкене происходит разрыв двойной связи с образованием кислородсодержащих продуктов: H3C—CH=CH—CH3 + 2O2 → 2H3C—COOH
- Окисление этена на серебряном катализаторе дает оксид этилена:
Ag, 350°C
2Н2С=СН2 + O2 → 2Н2С—СН2
\ /
О
Из оксида этилена получают уксусный альдегид, моющие средства, лаки, пластмассы, каучуки и волокна, косметические средства.
Реакция полимеризации
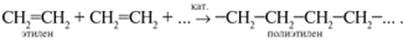
Процесс соединения многих одинаковых молекул в более крупные называется реакцией полимеризации.

Алкены широко используются в качестве мономеров для получения многих высокомолекулярных соединений (полимеров).
Реакция изомеризации. При нагревании или в присутствии катализаторов алкены способны изомеризоваться — происходит перемещение двойной связи или установление изостроения.
В природе алкены встречаются редко. Алкены – этен, пропен и бутен – при обычных условиях (20 °С, 1 атм) – газы, от С5Н10 до С18Н36 – жидкости, высшие алкены – твердые вещества. Алкены не растворимы в воде, хорошо растворимы в органических растворителях.

ДОМАШНЕЕ ЗАДАНИЕ:
