Возможны различные виды классификации комплексных соединений.
1. Комплексы могут быть моноядерными и полиядерными.
В первом случае в координационную сферу всходит один металл-комплексообразователь, во втором – несколько металлов.
Примеры: K2[PtCl6], [Co(NH3)3(NO2)3], K3[Co(NO2)6] – моноядерные комплексы;
Pt4(OCOCH3)8 – тетраядерный (полиядерный) комплекс.
2. Комплексы могут быть нейтральными, анионными или катионными.
Примеры: K2[PtCl6] –анионный комплекс,
[Co(NH3)3(NO2)3] – нейтральный комплекс
[Co(NH3)6]Cl2.- катионный комплекс.
3. Комплексы можно классифицировать по координационному числу КЧ (т.е. количеству координированных лигандов). КЧ бывают равными 1,2,3,4,5,6,7,8 и9.
Для моноядерных соединений наиболее часто встречаются КЧ 4 и 6.
4. Комплексы можно классифицировать по координационному полиэдру.
Координационный полиэдр – это геометрическая фигура, которая образуется после соединения прямыми линиями всех лигандов (их первых атомов). В центре такой фигуры располагается ион металла. Для моноядерных соединений характерны полиэдры в виде плоского квадрата, тетраэдра и октаэдра.
Примеры:

K2[PtCl4] (плоский квадрат)



WF6 K3[Co(NO2)6] K3[Fe(CN)6]
Октаэдр
3. Комплексы можно классифицировать, исходя из химической природы лигандов.
.
Координационная емкость лигандов (или дентатность) – это число координационных мест, которое занимает у центрального атома данный лиганд.
Примеры: монодентатные лиганды – аммиак, галогены, халькогены, и т.д.
Полидентатные лиганды – с.22 и далее
Бидентатные: карбонат, оксалат, этилендиамин
Тридентатные: диэтилентриамин
Тетрадентатные: этилендиаминтетрауксусная кислота.
Полидентатные лиганды, содержащие электронодонорные функциональные группы различного типа –кислотные и основные – называют комплексонами.
Пример: соль Цейзе – атомы этилена расположены на одинаковом расстоянии от атома платины и координационную емкость этилена можно было бы считать равной 2. Однако координационная емкость лиганда определяется числом монодентатных лигандов, которые могут заместить данный лиганд или которые замещаются данным лигандом. Поэтому для этилена КЕ = 1.
Классификация комплексов по химической специфике лигандов
1. Атомы элементов в качестве лигандов (H, O, N, C, S, Se, F, Cl и др.). Некоторые из них – координируются в виде одно- или двухзарядных анионов, другие не существуют в индивидуальном состоянии в мягких условиях (N, O, S).
ПРИМЕРЫКОМПЛЕКСОВ
А) гидридные комплексы (например, гидриды рения). В комплексе рения [ReH9]2- шесть атомов водорода находятся в вершинах тригональной призмы, а три атома водорода образуют правильный треугольник, лежащий на одинаковых расстояниях от обоих оснований призмы. Металл-комплексообразователь находится в центре этого треугольника.
б) галогенидные комплексы:
Например, соединение K2PdCl4 является анионным комплексом и содержит тетрахлоропалладат-анион (PdCl4)2- (см. рис. выше).
В) Халькогенидные комплексы, т.е. содержащие серу, селен, теллур, связанные с центральным атомом. Примеры:

Как правило, комплексы содержат лиганды разного типа или лиганды, состоящие из разных атомов. Например, карбонилгидридные комплексы содержат одновременно и карбонильные (СО), и гидридные (Н-) лиганды, как это видно на примере карбонилгидридов хрома [(CO)5Cr]2(μ-H) или рения (CO)3Re(μ-H)3Re(CO)3.
: 
В связи с вышесказанным такая классификация употребима главным образом для галогенидных или халькогенидных комплексов.
2. В качестве лигандов часто выступают отрицательно заряженные группы атомов – анионные лиганды –
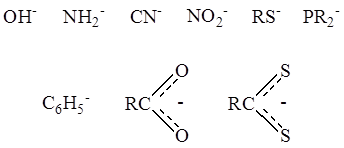
Примером может служить кластерный комплекс платины состава Pt4(OCOCH3)8 :

В кластере четыре атома платины образуют квадрат с коротким расстоянием металл-металл. По каждой стороне квадрата координированы по две мостиковых ацетатных группы. В координации каждой ацетатной группы участвуют в одинаковой мере оба карбоксилатных атома кислорода, поставляя для образования донорно-акцепторной связи пару электронов с каждого атома кислорода, а еще один электрон делокализован между этими двумя атомами кислорода.
3. Лигандами могут быть устойчивые двухатомные и многоатомные молекулы:
N2, O2, CO, NO, NH3, NR3, H2O, R2O, SO2, CS2, PR3, RCN, C6H6
ПРИМЕРЫ:
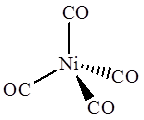

Ni(CO)4 Co2(CO)8
В тетракарбониле никеля Ni(CO)4 атом металла помещен в центр тетраэдра, образуемого 4 атомами углерода карбонильных групп, поэтому комплекс имеет тетраэдрическое строение. В иядерном дикобальтоктакарбониле Co2(CO)8 каждый атом кобальта имеет квадратно-пирамидальное окружение, причем основание квадратной пирамиды образуют 4 атома углерода карбонильных групп, а вершину этой пирамиды – второй атом кобальта.
В сэндвичевых соединениях – дибензолхроме (C6H6)2Cr и ферроцене (C5H5)2Fe атом металла располагается между двумя плоскими ароматическими молекулами, каждая из которых связана с атомом металла по π-типу:


4. Лигандами могут служить молекулы или фрагменты молекул, которые не существуют в свободном состоянии или являются чрезвычайно неустойчивыми (карбены, карбины, нитрены и т.д.)
Карбеновые комплексы:

Карбиновые комплексы

Нитреновые комплексы – это фактически азотсодержащие аналоги карбенов, где нитреновый лиганд связывается с центральным атомом за счет кратной связи металл-азот, как, например, в комплексе рения:

Классификация комплексов по специфике электронной конфигурации лигандов.
Этот тип классификации уже в какой-то мере отражает особенности химической связи металл-лиганд.
1. σ-лиганды – лиганды с одной или несколькими неподеленными парами электронов, локализованными на одном донорном атоме. Эти лиганды при взаимодействии с металлами образуют σ-комплексы. Их можно разделить на две группы:
а) лиганды, имеющие одну или несколько неподеленных σ-пар электронов и не имеющие энергетически доступных вакантных орбиталей – F-, H2O, ROH, NH3, H-,
б)?
2. π-лиганды – лиганды, донорные пары которых делокализованы на двух или более центрах и являются π-электронными парами. К таким лигандам относятся производные этилена, диенов, ацетилена, бензола и других ациклических и циклических ненасыщенных соединений.
ПРИМЕРЫ
Так, например, в анионе соли K[PtCl3(C2H4)] атом платины имеет плоско-квадратное окружение, в котором π-координированная молекула этилена занимает одно координационное место:
Или, например, в биc-π-аллильном комплексе никеля (см. рис.) каждый аллильный лиганд занимает 3 места в координационной сфере металла
