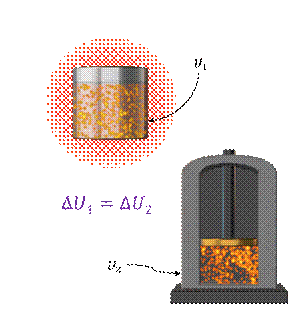При изучении механики мы с вами говорили о том, что полная механическая энергия замкнутой системы тел остаётся неизменной лишь в том случае, если между телами действуют только консервативные силы. Однако, если в такой системе будут действовать ещё и диссипативные силы (например, силы трения), то её механическая энергия не сохраняется. Но уменьшение механической энергии не означает, что она бесследно исчезла. Она лишь переходит из механической формы в другие и, в частности, во внутреннюю энергию. Чтобы в этом убедиться возьмите бутылку с водой и с помощью термометра измерьте её начальную температуру. Затем потрясите бутылку в течение нескольких минут и вновь измерьте температуру воды.

Как не удивительно, но она нагреется примерно на один — два градуса. Примерно то же самое происходит в морях и океанах во время сильных штормов.
В начале 30-х годов XIX в. на это явление обратил внимание немецкий учёный, врач по образованию Роберт Майер, который услышал о ней от своего моряка. История моряка наряду с некоторыми наблюдениями самого учёного, побудили его взяться за определение отношения количеств работы и теплоты. В начале 40-х годов Майеру удалось рассмотреть с качественной стороны превращения всех форм энергии, которые были известны в то время, и впервые сформулировать закон превращения и сохранения энергии в общей форме.
Известный английский физик Джеймс Прескотт Джоуль, ничего не знавший о работах Майера, в 1841 году после серии опытов, показал, что совершённая при перемешивании воды механическая работа практически равна увеличению её внутренней энергии.
Опираясь на работы Джоуля и Майера, а также других известных на то время научных данных, немецкий физик Герман Гельмгольц в 1847 году сформулировал закон превращения и сохранения энергии как всеобщий закон природы. В современной формулировке он звучит так: при любых взаимодействиях материальных объектов энергия не исчезает и не возникает из ничего, она только передаётся от одних объектов к другим или превращается из одной формы в другую.
Для термодинамических систем (напомним, что в термодинамике обычно рассматривают макроскопические неподвижные системы) закон сохранения и превращения энергии называют первым законом или первым началом термодинамики. Согласно ему, изменение внутренней энергии термодинамической системы при переходе из одного состояния в другое равно работе, совершённой внешними силами, и количеству теплоты, переданному термодинамической системе в процессе теплообмена:
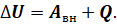
Для изолированной системы (то есть системы, которая не обменивается с внешней средой ни энергией, ни веществом) работа внешних сил равна нулю, как равно нулю и количество теплоты. В этом случае изменение внутренней энергии изолированной системы остаётся неизменной:

Если в такой системе имеются тела с различной температурой, то между ними будет происходить теплообмен: тела, у которых температура выше, будут отдавать энергию и охлаждаться, а тела с меньшей температурой будут получать энергию и нагреваться. Это будет происходить до тех пор, пока температуры всех тел не станут одинаковыми. Но суммарное изменение внутренней энергии тел системы всё равно будет равно нулю:
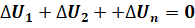
или же равно нулю суммарное количество теплоты, полученное при теплообмене между телами такой системы:
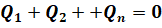
Таким образом, знакомое нам уравнение теплового баланса является математической записью первого начала термодинамики для теплоизолированной системы.
Поскольку работа внешних сил равна работе, совершаемой термодинамической системой, взятой с противоположным знаком (A вн = – A), то первый закон термодинамики можно сформулировать и так: количество теплоты, сообщённое термодинамической системе, идёт на изменение её внутренней энергии и на совершение работы системой против внешних сил:

Из первого закона термодинамики следует невозможность создания вечного двигателя первого рода, то есть устройства, способного бесконечно совершать работу без теплопередачи от внешних тел.

И действительно, если к системе не подводится теплота, то работа может быть совершена только за счёт убыли внутренней энергии. Когда запас энергии окажется исчерпанным, двигатель перестанет работать.

Для закрепления материала решим с вами несколько задач. Задача 1. В теплоизолированном цилиндре компрессора сжимают 3 моля идеального одноатомного газа. Определите изменение температуры газа за один ход поршня, если при этом была совершена работа 600 Дж.

Задача 2. Определите изменение внутренней энергии 1 кг идеального одноатомного газа, охлаждающегося при постоянном объёме, если его начальная температура равна 420 К, а давление уменьшилось с 7 до 2 паскалей. Удельная теплоёмкость газа равна 700 Дж/(кг ∙ К).

В заключении урока отметим, что в данном состоянии термодинамическая система всегда обладает внутренней энергией. Но это не означает, что в этой системе содержится определённое количество теплоты или работы, ведь эти величины являются характеристиками изменения внутренней энергии системы в результате какого-либо процесса. А измениться внутренняя энергия на одно и то же значение может как за счёт совершения системой работы без теплообмена с окружающими телами, так и за счёт передачи окружающим телам какого-либо количества теплоты.