1). окисление этанола: образуется либо карбоновая (уксусная) кислота
5С₂H₅OH + 4KMnO₄ + 6H₂SO₄ → 5CH₃COOH + 4MnSO₄ + 2K₂SO4 + 11H₂O
2) либо альдегид (этаналь):
5С₂H₅OH + 2KMnO₄ + 3H₂SO₄ → 5CH₃COH + 2MnSO₄ + K₂SO4 + 8H₂O
*поскольку вопрос звучит, как «реакции окисления на примере этанола», то части ответа помеченные «*» можно опустить.
ЗАДАЧА.
На нахождение молекулярной формулы органического соединения по массе продуктов сгорания.
ТЕКСТ. При сжигании 29 г углеводорода образовалось 88 г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Решение
1. Записать условие задачи.

2. Найти относительную молекулярную массу вещества:
Mr(CхHy) = Dвозд*Мr(возд.)= 2*29 = 58
3. Найти массу углерода:
в 44 г (CO2)-12 г углерода
в 88 г (CO2)-х г
Пропорцией находим х, х=24г
5. Таким же способом находим массу воды
в 18 г (H2O)-2г водорода
в 45 г (H2O)-у г водорода
у=5г
6. Найти простейшую формулу углеводорода:
m(C)/Ar(C): m(H)/Ar(H)= 24/12: 5/1 = 2: 5
следовательно, простейшая формула – С2Н5.
7. Найти истинную формулу углеводорода:
{Мr(C2H5) = 29, увеличиваем в два раза
{Mr (CхHy) = 58,
следовательно, истинная формула – C4H10.
Билет 2
1.Предельные углеводороды, общая формула и химическое строение гомологов данного ряда. Свойства и применение метана.
2.Сахароза – представитель дисахаридов. Строение, свойства и применение.
3. Задача. Нахождение молекулярной формулы газообразного углеводорода по его относительной плотности и массовой доли элементов в соединении.
1. Предельные углеводороды- углеводороды, в молекуле которых все валентности атома углерода насыщены до предела.
СnH2n+2- общая формула.
Химическое строение.
Все атомы углерода находятся в sp3 гибридизации. Длина связи С-С = 0.154 нм. Угол связи= 109○28ﹶ. Алканы являются мало реациоными соединениями, относительно других классов органических соединений.
Гомологи- вещества, сходные по строению и свойствам, но отличающиеся друг от друга на одну или несколько гомологических разностей (СН2)
Гомологический ряд:
СН4- метан
С2H6- этан
С3H8- пропан
С4H10- бутан
С5H12- пентан
С6H14- гексан
С7H16- гептан
С8H18- октан
С9H20- нонан
С10H22- декан
Изомеры- это вещества, которые имеют одинаковый состав и одинаковую молекулярную массу, но различное строение молекул, следовательно разные свойства.
Предельным углеводородам свойственна изомерия углеродного скелета: С4H10. CH3-CH2-CH2-CH3 или CH3 –CH(CH3)-CH3.
С увеличением числа углеродных атомов в молекуле алкана число изомеров увеличивается.
Метан- это газ без цвета и запаха, в два раза легче воздуха, с воздухом образует взрывоопасные смеси
Хим. Свойства.
1. Горение
СН4+2O2 → CO2+2H2O
Подтверждает наличие С и Н метане
2. Пиролиз
а) неполный
2СН4 → С2Н2+3Н2↑
б) полный
СН4 → С+2Н2↑
3. Галогенирование – по типу реакции замещения. Проходит по свободно-радикальному механизму. На свету.
CH4 + Cl2 → CH3Cl + HCl
CH3Cl + Cl2 → CH2Cl2 + HCl
CH2Cl2 + Cl2 → CHCl 3 + HCl
CHCl 3 + Cl2 → CCl4 + HCl
Бронирование проходит медленнее, чем хлорирование=> селективнее. Йодирование почти не идет, а фторирование черезвычайно интенсивно, даже при низких температурах. Замещение происходит в первую очередь при третичном атоме углерода, затем у вторичного, и только затем у первичного.
*4. Изомеризация. Катализатор AlCl3
CH3-CH2-CH2-CH3 → CH3 –CH(CH3)-CH3
*5. Циклизация
СН4-Н10->С4Н8+Н2
* ЧИТАЕМ БЕЛЕТ: «СОЙСТВА МЕТАНА»…
Применение МЕТАНА
В быту как топливо, производство сажи (нужна для изготовления типографской краски и резиновых изделий), основной источник получения водорода в промышленности (для орг. соед. и для синтеза аммиака.), продукты хлорирования метана используются как растворители.
2. Дисахариды – это углеводы, молекулы которых состоят из двух остатков моносахаридов, соединенных друг с другом за счёт взаимодействия гидроксильных групп. Гликозидны –связи соединяющие моносахаридные остатки. Наиболее широко распространенным дисахаридом является сахароза (тростниковый или свекловичный сахар). Получают его из сахарного тростника или из сахарной свеклы. Молекула сахарозы состоит из остатков глюкозы и фруктозы, соединенных друг с другом за счет гликозидной связи. С12O22Н11- молекулярная формула сахарозы.
Физические свойства
Чистая сахарозы – бесцветное кристаллическое вещество сладкого вкуса, хорошо растворимое в воде.
Химические свойства:
1) Подвергается гидролизу. Продукты- глюкоза и фруктоза. В присутвии сильных кислот.
С12Н22O11 + H2O → C6H12O6 + C6H12O6
2) Сахароза – невосстанавливающий сахар. Она не даёт реакции «серебряного зеркала», а с гидроксидом меди (II) взаимодействует как многоатомный спирт, не восстанавливая Cu (II) до Cu (I).
3) Образование сахаратов.
С12Н22O11 + Ca(OH)2 → С12Н22O11 • CaO + H2O
4) образование сложных и простых эфиров как многоатомные спирты.
Применение
Сахароза в основном используется в качестве продукта питания и в кондитерской отрасли промышленности. Путём гидролиза из неё получают искусственный мёд.
ЗАДАЧА. На нахождение молекулярной формулы газообразного углеводорода по его относительной плотности и массовой доли элементов в соединении.
ТЕКСТ. Плотность алкена по азоту равна 1. Содержание в этом алкене углерода – 85,71%, водорода – 14,29%. Определите формулу вещества.
Решение:
CxHy
1. Mr(CxHy)= D(N2)*28 (столько весит молекула азота)= 28
2. x: y = ω(C)/Ar(c): ω (H)/Ar(H) = 7.1425: 14.29 = 1: 2
Следовательно CH2 простейшая формула.
3. Проверка
Мr(CH2)= 14} увеличиваем в два раза, следовательно C2H4 - истинная форм.
Mr(CxHy)= 28}
Ответ: C2H4.
ПРИМЕЧАНИЕ: относительная плотность по воздуху домнажается на 29 чтобы Mr(вещ.), а значение относительной плотности по водороду на 2, если плотность по гелею то на 4, для азота на 28, Вроде это все газы по которым обычно могут дать плотность вещества.
Билет 3
1.Непредельные углеводороды, общая формула и химическое строение гомологов алкенов. Свойства и применение этилена.
2.Типы изомерии в органической химии.
З. Задача. Нахождение молекулярной формулы органического соединения по объёму и массе продуктов сгорания.
1. Алкены – непредельные углеводороды, содержащие в своем составе между атомами С одну двойную связь. Их еще назвают: алифатические углеводороды, алефины, этиленовые углеводороды.
Формула: СnН2n
В молекулах алкенов атомы углерода, образующие двойную связь. находятся в sp2 – гибридизации.
Угол связи в алкенах составляет 120°. Молекула в области двойной связи имеет плоскостную структуру, то есть все связи лежат в одной плоскости. Двойная связь представлена одной σ и одной π - связями. Для алкенов характерны реакции присоединения, протекающие с разрывом π – связи (присоединения).
В симметричных алкенах связь не поляризована. В несимметричных алкенах поляризация связи зависит от электронных свойств заместителя. Так, в молекуле пропена CH3−CH=CH2 метильная группа, обладающая положительным индуктивным эффектом +1 (отталкивает от себя общую электронную пару), вызывает перераспределение электронной плотности двойной связи, что приводит к локализации частичного отрицательного заряда на концевом атоме углерода, образующем двойную связь. Поэтому в реакциях электрофильного присоединения положительная частица - электрофил (например, протон водорода H+ начинает атаку именно по этому атому. В этом случае выполняется правило Марковникова (водород присоединяется туда. где больше водорода):

Этилен – алкен с формулой С2Н4.
Получение:
1. Дегидрогалогенирование (действие спиртовых растворов щелочей на моногалогенпроизводные УВ).
CH3-CH2-Cl + KOH (спирт. р-р) → CH2 = CH2 + KCl + H2O
2. Дегалогенирование (действие металлического Zn или Mg на дигалогенпроизводные с двумя атомами галогена у соседних атомов).
Сl-CH2-CH2-Cl + Zn → ZnCl2 + CH2=CH2

3. Дегидратация (действие H2SO4 на этанол при его нагревании (t >170C°))
CH3-CH2-OH → CH2=CH2 + H2O
4. Дегидрирование этана при нагревании (500°С) в присутствии катализатора (Ni, Pt, Pd)

Свойства этилена
Реакции присоединения
1. Галогенирование (электрофильное присоединение) — взаимодействие этилена с галогенами, например, с бромом, при котором происходит обесцвечивание бромной воды.
CH2=CH2 + Br2 → Br-CH2-CH2Br.
2. Галогенирование этилена возможно также при нагревании (300○С), в этом случае разрыва двойной связи не происходит – реакция протекает по механизму радикального замещения. Реакция Львова.
CH2=CH2 + Cl2 → CH2=CH-Cl + HCl.
3. Гидрогалогенирование — взаимодействие этилена с галогенводородами (HCl, HBr) с образование галогенпроизводных алканов.
CH2=CH2 + HCl → CH3-CH2-Cl.
4. Гидратация — взаимодействие этилена с водой в присутствии минеральных кислот (серной, фосфорной) с образованием предельного одноатомного спирта – этанола.
CH2=CH2 + H2О → CH3-CH2-ОН.
5. При восстановлении этилена происходит образование этана, представителя класса алканов. Реакция восстановления (реакция гидрирования) этилена протекает по радикальному механизму. Условием протекания реакции является наличие катализаторов (Ni, Pd, Pt), а также нагревание реакционной смеси:
CH2=CH2 + H2 = CH3-CH3.
Реакции окисления.
В ходе реакций окисления этилена возможно образование различных продуктов, причем состав определяется условиями проведения окисления.
1. Реакция Вагнера. При окислении этилена в мягких условиях (окислитель –водный раствор перманганата калия) происходит разрыв π-связи и образование двухатомного спирта — этиленгликоля.
3CH2 = CH2 + 2KMnO4 +4H2O → 3CH2(OH)-CH2(OH) +2MnO2 + 2KOH.
2. При жестком окислении этилена кипящим раствором перманганата калия в кислой среде происходит полный разрыв связи (σ-связи) с образованием муравьиной кислоты и углекислого газа:

3. Вакер процесс. Окисление этилена кислородом при 200С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
2CH2=CH2 + O2 = CH3-CH=O.
Реакция полимеризации
Полимеризация — процесс образования высокомолекулярного соединения – полимера-путем соединения друг с другом молекул исходного низкомолекулярного вещества – мономера.
nCH2=CH2 = (-CH2-CH2-)n.
2. Различают два вида изомерии: структурную и пространственную (стереоизомерию). Структурные изомеры отличаются друг от друга порядком связи атомов в молекуле, стерео-изомеры — расположением атомов в пространстве при одинаковом порядке связей между ними.
Выделяют следующие разновидности структурной изомерии: изомерию углеродного скелета, изомерию положения, изомерию различных классов органических соединений (межклассовую изомерию).
Структурная изомерия
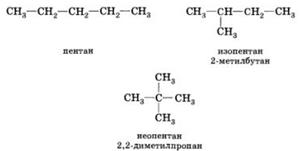
Изомерия углеродного скелета обусловлена различным порядком связи между атомами, образующими скелет молекулы. Как уже было показано, молекулярной формуле С4Н10 соответствуют два углеводорода: н-бутан и изобутан. Для углеводорода С5Н12 возможны три изомера: пентан, изо-пентан и неопентан.
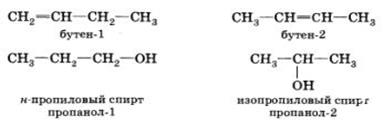
Изомерия положения обусловлена различным положением кратной связи, заместителя, функциональной группы при одинаковом углеродном скелете молекулы:
Изомерия различных классов органических соединений (межклассовая изомерия) обусловлена различным положением и сочетанием атомов в молекулах веществ, имеющих одинаковую молекулярную формулу, но принадлежащих разным классам. Так, молекулярной формуле С6H12 соответствует ненасыщенный углеводород гексен-1 и циклогексан:

Изомеры этого типа содержат различные функциональные группы и относятся к разным классам веществ. Поэтому они отличаются по физическим и химическим свойствам значительно больше, чем изомеры углеродного скелета или изомеры положения.
Пространственная изомерия подразделяется на два вида: геометрическую и оптическую.
Геометрическая изомерия характерна для соединений, содержащих двойные связи, и циклических соединений. Так как свободное вращение атомов вокруг двойной связи или в цикле невозможно, заместители могут располагаться либо по одну сторону плоскости двойной связи или цикла (цис-положение), либо по разные стороны (транс-положение). Обозначения цис- и транс- обычно относят к паре одинаковых заместителей.

Оптическая.
Возникает если молекула имеет ассиметричный (атом водорода соединен с 4 разными заместителями) углеродный атом. Примеры данных соединений- АК, углеводы (это классикап, это знать надо).
ЗАДАЧА* Загляните в свои тетради и посмотрите на оформление задачи (в разделе алкины в самом начале темы), хотя это тоже правильно. Выберите то решение, которое вам понятнее.
На нахождение молекулярной формулы органического соединения по объёму и массе продуктов сгорания.
ТЕКСТ
При сжигании 5,6 л (н. у.) газообразного органического вещества было получено 16,8 л (н. у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества при н. у. равна 1,875 г. Найти его молекулярную формулу.
Решение
1. Записать условие задачи.

2. Найти молекулярную массу вещества из пропорции:
1 л газа – 1,875 г,
22,4 л – m г.
Отсюда m = 42 г, M = 42 г/моль.
3. Найти количество вещества углекислого газа и углерода:
(CO2) = 16,8/22,4 = 0,75 моль,
(C) = 0,75 моль.
4. Найти количества веществ воды и водорода:
(H2O) = 13,5/18 = 0,75 моль,
(H) = 0,75•2 = 1,5 моль.
5. Найти сумму масс углерода и водорода:
m(C) + m(H) = 0,75•12 +1,5•1 = 10,5 г.
6. Найти массу сожженного вещества:

Следовательно, вещество содержит только углерод и водород.
7. Найти простейшую формулу углеводорода CхHy:
(C): (H) = 0,75: 1,5 = 1: 2, следовательно, простейшая формула – СН2.
8. Найти истинную формулу углеводорода:
Mr(CH2) = 14,
Mr(в-ва): Mr(CH2) = 42: 14 = 3,следовательно, истинная формула – С3Н6.
Билет 4
1.Диеновые углеводороды, их химическое строение, свойства, получение и практическое значение.
2.Термический и каталитический крекинг.
3. Задача. Вычисление объёма газа, необходимого для реакции с определённым объёмом другого газа1. Диеновые углеводороды- углеводороды которые имеют две двойные связи. Общая формула CnH2n-2.
Типы изомерии: углеродного скелета, положение двойных связей, межклассовая (изомерны алкенам), а также геометрическая (цис-транс)
По строению различают три вида: диеновых УВ с изолированными двойными связями (между двойными связями более одной простой C-C связи)(CH2=CH-CH2-CH=CH2). Кумулированные двойные связи (двойные связи при одном атоме углерода)(CH2=C=CH2). Сопряженные двойные связи (двойные связи расположены через одну одинарную связь)(CH2=CH-CH=CH2).
Химические свойства диеновых УВ с изолированными и кумулированными связями аналогичны свойствам алкенов, т.е вступают в реакцию присоединения.
2)Свойства же сопряженных диенов отличаются благодаря перекрыванию p-орбиталей всех 4 атомов C, которые находятся в sp2 гибридизации. Из-за чего изменяются и длины связей С=С увеличивается, а длина С-С уменьшается(имеется ввиду одинарная связь между двойными).
Реакции присоединения.
Основная особенность сопряженной системы заключается в том что она реагирует как единое целое, поэтому продукта 1,4 присоединения больше.

 CH2Br-CH=CH-CH2Br (1,4-присоединение)
CH2Br-CH=CH-CH2Br (1,4-присоединение)
 CH2=CH-CH=CH2+Br2→ 80% 1,4-дибромбутен-2
CH2=CH-CH=CH2+Br2→ 80% 1,4-дибромбутен-2
CH2Br-CHBr-CH=CH2(1,2-присоединение)
20% 3,4-дибромбутен-1
3)Получение:
а) Реакция Лебедева (можно рассматривать как межмолекулярное дегидрирование и внутримолекулярную дегидратацию)
2C2H5OH→CH2=CH-CH=CH2; катализатор- смесь Al2O3 и ZnO, t○
б) Более общий способ (Элиминирование дигалогенопроизводных алканов спиртовым раствором щёлочи).
CH2Br-CH2-CH2-CH2Br + 2KOH → CH2=CH-CH=CH2 + 2KBr + 2H2O
4)Практическое значение.
Именно диеновые УВ являются сырьем для получения синтетических каучуков. Первым из них был получен бутадиеновый (Лебедев, СССР, 1928). Был плохого качества,т.к звения постоянно чередовались (цис-транс-конфигурация). Это избегается при использовании катализатора Циглерра-Натта(комплексные металлорганические катализаторы, Например смесь TiCl4 и Al(C2H5)3). Общим недостатком УВ каучуков являеется их низкая термическая устойчивость, набухание и разрушение в нефтепродуктах (бензинах, маслах). Этих недостатков лишен хлоропреновый каучук (мономер-хлоропрен CH2=CCl-CH=CH2). Бутадиен-стирольный каучук представляет собой сополимер (в качестве мономеров участвуют различные соединения с кратными связями). Благодаря газонепроницаемости данный каучук используют для изготовления автомобильных камер, а также транспортных лент. Синтетические каучуки являются одним из основных продуктов химической промышленности. При нагревании каучука с серой отдельные полимерные цепи сшиваются между собой за счет образование -S-S- связей (вулканизация). Продукт частичной вулканизации-резина менее эластична чем каучук, но более прочная чем сам каучук. Имеет разветвленную пространственную структуру. При увеличении кол-во серы продукт приобретает сетчатую структуру, при этом полностью теряет свою эластичность. Он называется эбонитом.
2. Крекинг - процесс термического или каталитического расщепления молекул тяжелых УВ на УВ с меньшим количеством атомов С в цепи.
Термический крекинг (В. Г. Шухов и С. П. Гаврилов)
Условия: t○=450-550; Ρ=2-7 Мпа.
Продукты – алканы и алкены нормального строения.
Каталитический крекинг
Условия: t○=450-500; кат Al2O3•SiO2 (читается как смесь оксидов…)
Продукты – алканы и алкены разветвленного строения.
ЗАДАЧА. На вычисление объёма газа, необходимого для реакции с определённым объёмом другого газа.
ТЕКСТ
Какой объем кислорода потребуется для сжигания метиламина объемом 44.8 л?
Решение:
1) оформить дано: V(CH3NH2)=44.8; Vm=22.4 литр/моль
2) записать уравнение реакции и решить эту хрень
44.8 л. х л.
4 CH3NH2 + 9 O2 = 4 CO2 + 10 H2O + 2 N2↑
89.6л 201.6л.
1 вариант 2 вариант
V(CH3NH2)=Vm*n=22.4 л/моль*4 моль=89.6 л. Х:44.8л= 4 моль: 9 моль
V(O2)= Vm*n=22.4 л/моль*9 моль= 201.6 л. Х=44,8л.*9моль/4моль
Х:44.8л. = 201.6л.:89.6л. Х=100.8 л
Х=44.8л.*201.6л. /89.6л.
Х=100.8 л.
Билет 5
1.Ацетилен – представитель углеводородов с тройной связью в молекуле. Свойства, получение и применение ацетилена.
2. Строение атома углерода. Валентные возможности атома углерода.
3. Задача. Вычисление по уравнению реакции, если одно из исходных веществ дано в избытке.
1.Алкины – углеводороды, содержащие в своем составе одну тройную связь между атомами углерода.
Физические свойства: бесцветный газ; легче воздуха; не обладает запахом;
плохо растворим в воде, лучше – в органических растворах; с воздухом образует взрывоопасные смеси.
Химические свойства:
Реакции присоединения.
1. Гидрирование протекает в 2 стадии.
 kt – Ni, Pt, Pd.
kt – Ni, Pt, Pd.
2. Галогенирование (обесцвечивание бромной воды протекает с большим трудом).
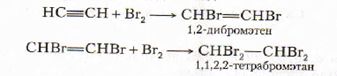
3. Гидрогалогенирование. По правилу Марковникова.
HC≡CH + HBr → H2C=CHBr
H2C=CHBr + HBr → H3C-CHBr2
4. Гидратация (реакция Кучерова) – в присутствии сульфата ртути(II), в кислой среде.
 ацетальдегид
ацетальдегид
5. Димеризация ацетилена. Катализатор- CuCl (хлорид меди (I)), NH4Cl.
2HC≡CH → H2C=CH-C≡CH (винил ацетилен, или бутен-1-ин-3).
6. Тримеризация. Реакция Бертло-Зелинского. Катализатор- активированный уголь, t○
3HC≡CH → C6H6
7. Взаимодействие с аммиачным раствором оксида серебра (I). Только для алкинов, у которых тройная связь находится на конце (терминальных). Пример кислых свойств алкинов
HC≡CH + 2[Ag(NH3)2]OH → AgC≡CAg↓ + 4NH3 + 2H2O
8. Взаимодействие с натрием. t○=150○С
HC≡CH + 2Na → NaC≡CNa + H2↑
Реакции окисления.
1.Горение (горит в чистом кислороде ослепительно-белым пламенем). На воздухе ярким коптящим пламенем.

2. Окисление водным раствором KMnO4. Окисляеется до щевелевой кислоты (HOOC-COOH), которая затем сразу же реагирует с образующимся KOH, образуя оксалат калия.
3HC≡CH + 8KMnO4 + 4H2O → 3HOOC-COOH + 8MnO2 + 8KOH
3HOOC-COOH + 6KOH → 3KOOC-COOK + 3H2O
3. В более жестких условиях окисляется до CO2 и H2O. При нагревании.
C2H2 + 2KMnO4 + 3 H2SO4 → 2CO2 + K2SO4 + 2 MnSO4 + 4 H2O
Получение:
1. Из карбида кальция. (Лабораторный способ)
СаС2 + 2Н2О → С2Н2 ↑ + Са(ОН)2
2.Термическое разложение метана.
2СН4 → С2Н2 + 3Н2↑
3. Дигедрирование дигалоген алканов. При нагревании.
CH2Br-CH2Br + 2 KOH (спирт. р-р) → HC≡CH + 2KBr + 2H2O
4. Дигалогенирование тетра галогенпроизводных. При нагревании.
CHBr2-CHBr2 + 2Zn → HC≡CH + 2ZnBr2
Применение:
- для сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (уже не применяется).
- в производстве взрывчатых веществ (ацетелиниды)
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучуков, ароматических углеводородов.
2. Валентность - число одинарных связей, которые данный атом образует с другими атомами.
Строение атома углерода:
Атом углерода как элемент главной подгруппы IV группы имеет четыре валентных электрона, что отражает электронная формула 2s2 2р2 или графическая формула:

Атом углерода может быть двухвалентным, образуя две ковалентные связи за счет двух неспаренных электронов по механизму обобществления (спаривания) электронов. (например, в CO) или же четырех валентным (CH 4, CO 2). В большинстве соединений атом углерода четырех валентный. Это связанно с тем, что несмотря на то что затрачивается определенная энергия на переход в возбужденное состояние, она ополностью окупается при образовании четерех ковалентных связей. *Энергия требуемая на переход в возбужденное состояние примерно 360 кДж/моль, а энергия выделяющаяся при образовании 4 С-Н связей 1640 кДж/моль. Несмотря на то, что неспаренные электроны находятся на разных подуровнях, связи, которые образуют эти электроны - равноценны. Это объясняется явлением, которое называется гибридизацией (выравнивание АО по форме и энергии).
ЗАДАЧА. На вычисление по уравнению реакции, если одно из исходных веществ дано в избытке.
ТЕКСТ. Смешали два раствора, содержащих соответственно 33,3 г хлорида кальция и 16,4 г фосфата натрия. Вычислите массу образовавшегося фосфата кальция.
Решение:
Дано:
m(CaCl2)=33,3 г
m(NaЗРО4)=16,4 г
Найти: m(CaЗРО4)2-? Г
1. Запишем уравнение реакции
33.3 г 16.4 г х г
ЗCaСl2+2NaЗРО4 = Сa3(PO4)2↓+6NaСl
333г 328г 310г
m(CaСl2)=M(CaСl2)*n= 111 г/моль *3 моль = 333 г
m(NaЗРО4)=M(NaЗРО4)*n= 164 г/моль*2моль =328 г
m(Сa3(PO4)2)=M(Сa3(PO4)2)*n=310 г/моль*1моль =310 г
2. Определим, какой из реагентов взят в избытке.
n(CaСl2)=m(CaСl2)/M(CaСl2)=33.3 г /333 г/моль = 0,1моль хлорид кальция взят в избытке
n(NaЗРО4)= m(NaЗРО4)/M(NaЗРО4)=16.4 г / 328 г/моль = 0,05 моль
Расчет ведем по фосфату натрия
16.4 г: х г = 328 г: 310 г
х г = 16.4 г *310 г /328 г= 15.5 г
Ответ: m(Сa3(PO4)2)=15.5 г
Билет 7
Вопросы:
1.Природные источники углеводородов: нефть, природный газ и их практическое использование.
2.Сложные эфиры, состав, строение, химические свойства, нахождение в природе. Реакция этерификации.
3. Задача. Вычисление массы продукта реакции по известной массе раствора с определённой массовой долей растворённого вещества.
1. Нефть – одно из важнейших природных ископаемых. Сырая природная нефть – вязкая жидкость темно – коричневого или черного цвета. В состав нефти входят восновном углеводороды трех классов: алканы, циклоалканы и арены. Состав сырой нефти зависит от месторождения. Основными компонентами нефти являются неразветвленные и разветвленные углеводороды с числом атомов углерода от одного до сорока. Циклоалканы нефти, которые часто называют нафтенами – это в основном метил- и этилзамещенные циклопентаны и циклогексаны. Ароматические углеводороды(бензол и его гомологи) содержатся в нефти в меньших количествах, чем алканы и нафтены. Нефть содержит также органические соединения серы, азота и кислорода. Более 90% добываемой нефти идет на производство различных видов топлива и только около 10% - на химическую переработку.
Сырая нефть не используется без переработки ни в качестве топлива, ни в качестве химического сырья. Важными продуктами переработки нефти являются смазочные масла. Современная переработка нефти делится на первичную и вторичную.
Главная операция первичной переработки нефти – ее перегонка, которая позволяет разделить нефть на фракции. Этот процесс основан на том, что разные вещества кипят при разной температуре. Перегонка происходит в ретификационной колонне при сильном нагревании. Самые тяжелые фракции, которые при сильном нагревании разлагаются, перегоняют при пониженном давлении.
Многие продукты перегонки нефти можно применять сразу, без дальнейшей переработки. Пропан – бутановую фракцию получаемого газа часто отделяют сжижением от более летучих метана и этана и используют в виде сжиженного газа в баллонах. Наибольшую ценность имеют легкие фракции перегонки – бензин и керосин, выход которых при простой перегонке невелик (до 15%). Кроме того, бензин после перегонки получается низкого качества, так как нефть в основном содержит углеводороды с неразветвленным углеродным скелетом, которые непригодны как горючее для современных двигателей. Очень важно, чтобы бензин в двигателе сгорал без детонации(без «стука»). Устойчивость бензина к детонации выражают октановым числом. Октановое число н – гептана принято за ноль, а октановое число 2,2,4-триметилпентана (изооктана) считается равным 100. Неразветвленные алканы имеют низкие октановые числа, наиболее высокие октановые числа имеют разветвленные алканы и ароматические углеводороды. Для современных автомобильных двигателей требуется горючее с октановым числом 90-100. Для повышения качества бензина и увеличения его выхода выделяемые фракции нефти подвергают дальнейшей химической переработке.
Остаток, полученный при атмосферной перегонке нефти – мазут, применяют в качестве котельного топлива или перегоняют под вакуумом для получения различных смазочных масел (соляровое, веретенное, трансформаторное). Наконец, гудрон – остаток вакуумной перегонки мазута – используют для производства битума, асфальта.
В нефтехимичесской промышленности нефть и газ служат сырьем для получения самых разнообразных органических соединений. Но в любом случае продукты первичной перегонки нефти подвергают последующей переработке.
Природные горючие газы – это собственно природный газ, попутный газ, выделяемый при добыче нефти. Основным компонентом природных газов является метан, содержание которого может составлять от 70% до 99%. Помимо метана природные газы содержат этан, пропан бутаны, а также небольшие количества азота, углекислого газа, сероводорода и инертных газов – гелия и аргона.
Природный газ используют в первую очередь как эффективное топливо. При его сгорании не образуется ни зола, ни ядовитый угарный газ, поэтому природный газ считается экологически чистым топливом. Большое количество природного газа использует химическая промышленность. Его переработка ведется в двух направлениях. Первое получение низших алкенов – этилена, пропена и алкина ацетилена. Второе получение синтез-газа смеси оксида углерода (II) и водорода, из которой, применяя различные катализаторы, синтезируют кислородсодержащие соединения – метиловый спирт, формальдегид, и др. На сегодняшний день природные газы служат единственным источником промышленного производства гелия
2. СЛОЖНЫЕ ЭФИРЫ–органические соединения, состоящие из остатка спирта и карбоновой кислоты.
Если исходная кислота многоосновная, то возможно образование либо полных эфиров – замещены все НО-группы, либо кислых эфиров – частичное замещение.
Химические свойства сложных эфиров
Гидролиз
а) Щелочной гидролиз. Проводится при нагревании
R-COO-R1 + NaOH → R-COONa + R1-OH
б)Также возможен обычный гидролиз, при этом он протекает гораздо медление чем щелочной.
R-COO-R1 + H2O → R-COOH + R1-OH
в) Кислотный гидролиз. Реакция обратима.
R-COO-R1 + H2O → R-COOH + R1-OH
Гидролиз в присутствии щелочей называют омылением.
Также возможны реакции по радикалу (имеется ввиду, по двойной связи).
Основной способ синтеза – взаимодействие карбоновой кислоты и спирта, катализируемое кислотой и сопровождаемое выделением воды. Чтобы процесс шел в нужном направлении (синтез сложного эфира), из реакционной смеси отгоняют воду. Специальными исследованиями с применением меченых атомов удалось установить, что в процессе синтеза атом О, входящий в состав образующейся воды, отрывается от, а не от спирта.
R-COOH + R1-OH → R-COO-R1 + H2O в присутствии кислот обычно H2SO4(конц.).
По такой же схеме получают сложные эфиры неорганических кислот, например, нитроглицерин.
Вместо кислот можно использовать хлорангидриды кислот, метод применим как для карбоновых, так и для неорганических кислот.
R-COCl+R1-OH → R-COO-R1 + HCl
Взаимодействие солей карбоновых кислот с моногалогеналканами R-Hal, где Hal- это Cl,Br,I. также приводит к сложным эфирам, реакция удобна тем, что она необратима – выделяющаяся неорганическая соль сразу удаляется из органической реакционной среды в виде осадка.
R-COONa + R1-Cl → R-COO-R1 + NaCl
Применение.
Сложные эфиры нашли свое применение в пищевой и парфюмерной промышленности, в качестве отдушек и усилителей запаха. Сложные эфиры (главным образом уксусной кислоты) являются прекрасными растворителями органических веществ и полимеров. Также являются сырьем для получения полимеровю. Поливенилацетат- венилацетат(мономер)- сложный эфир уксусной кислоты и непредельного винилового спирта(CH2=CH-OH этенол).
Нахождение в природе.
Сложные эфиры низших и средних карбоновых кислот являются составными частями природных эфирных масел в плодах пастернака — амиловый эфир масляной кислоты, в сивушном масле виноградного вина — главным образом изоамиловый эфир каприновой кислоты С9Н19СООС5Н11.
Реакция этерификации — простейший и наиболее удобный метод получения сложных эфиров. Проводится при нагревании в присутствии концентрированной серной кислоты.
ЗАДАЧА. На вычисление массы или объем продукта реакции по известной массе или объему исходного вещества, содержащего примеси.
ТЕКСТ. Сколько литров углекислого газа можно получить из 119 грамм известняка, содержащего 16% примесей?
Решение:
1. Находим массовую долю карбоната кальция в известняке:
ω(CaCO3) = ω(вещ.)- ω(прим) =100% − 16% = 84%
2. Находим чистую массу карбоната кальция:
m(CaCO3) = 119 г * 84%/100%= 100 г
3. Пишем уравнение реакции, подставляем сверху данные по условию задачи, снизу данные согласно уравнению:
100 г x л
CaCO3 = CaO + CO2↑
100 г 22,4 л
m(СаСО3)=M*n=100г/моль * 1моль = 100г
V(CO2)=Vm*n=22,4л/моль * 1моль= 22,4 л/моль
100г: х л=100г: 22,4 л
x=100г * 22,4 л / 100г= 22,4 л
Билет 8
1.Предельные одноатомные спирты, их строение, свойства. Получение и применение этилового спирта.
2. Лекарства, лекарственные формы и их роль в жизни человека.
3. Задача. Нахождение молекулярной формулы органического соединения по массе и объёму продуктов сгорания.
1. Спирты- органические вещества в молекулах которых содержится одна или нескольких гидроксогрупп связанных с УВ радикалом.

 + образование сложных эфиров
+ образование сложных эфиров
+ гидрирование уксусного альдегида (кат.-Pt)
+ спиртовое брожение
 , в производстве дивинила, как растворитель в производстве фармацевтических и душистых веществ, хороший антисептик.
, в производстве дивинила, как растворитель в производстве фармацевтических и душистых веществ, хороший антисептик.
2) Лекарства - это группа веществ, направленных на устранение признаков заболевания, различных по своей форме, действию и динамике.
Лекарства как химические вещества применяют внутрь или наружно с целью: лечения, диагностирования заболевания или уменьшения боли; оценки физического, функционального или психического состояния больного; восполнения потерь крови или других жидкостей организма; обезвреживания болезнетворных микроорганизмов; влияния на функции организма или психическое состояние человека и т.д.
Под лекарственными формами понимают состояние лекарственных препаратов, удобных для приема человеком (геометрическая форма, вкус, агрегатное состояние).
Агрегатное состояние влияет на скорость воздействия лекарства: твердые лекарственные формы действуют медленнее жидких.
Основные формы лекарственных средств
Лекарственные средства могут иметь различную консистенцию:
газообразная – аэрозоли, газы;
жидкая – сатурации, микстуры, суспензии, эмульсии, слизи, экстракты, настойки, отвары, настои, растворы;
мягкая – пластыри, суппозитории, линименты, пасты, мази;
твердая – сборы, драже, пилюли, таблетки, порошки.
Роль лекарственных средств в жизни человека велика. Они могут вылечивать не только заболевания, но и не дать заболеть человеку, поддержать его работоспособность. Также лекарство может оказывать не только лечебное действие, но так, же может иметь и побочное действие. Не существует на сегодняшний день лекарственных препаратов, которые действовали на один орган или систему. После их приема, в организме могут остоватся токсичные вещества.
Также лекарственные препараты могут взаимодействовать между собой, при приеме их одновременно, что в свою очередь может усиливать лечебное действие, а может и привести к неприятным побочным эффектам. Поэтому обязательно нужно проконсультировать с врачом.
ЗАДАЧА. * Загляните в свои тетради и посмотрите на оформление задачи (в разделе Алкины в самом начале темы), хотя это тоже правильно. Выберите то решение, которое вам понятнее.