Ковалентная связь
Металлическая связь, как вы помните, обеспечивается газом свободных электронов, который, подобно клею, удерживает положительные ионы в узлах кристаллической решётки. Полупроводники устроены иначе — их атомы скрепляет ковалентная связь. Давайте вспомним, что это такое.
Электроны, находящиеся на внешнем электронном уровне и называемые валентными, слабее связаны с атомом, чем остальные электроны, которые расположены ближе к ядру. В процессе образования ковалентной связи два атома вносят «в общее дело» по одному своему валентному электрону. Эти два электрона обобществляются, то есть теперь принадлежат уже обоим атомам, и потому называются общей электронной парой (рис. 2).
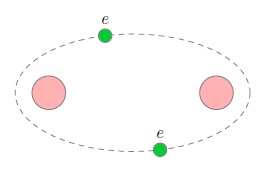
Рис. 2. Ковалентная связь
Обобществлённая пара электронов как раз и удерживает атомы друг около друга (с помощью сил электрического притяжения). Ковалентная связь — это связь, существующая между атомами за счёт общих электронных пар. По этой причине ковалентная связь называется также парноэлектронной.
Кристаллическая структура кремния
Теперь мы готовы подробнее изучить внутреннее устройство полупроводников. В качестве примера рассмотрим самый распространённый в природе полупроводник — кремний. Аналогичное строение имеет и второй по важности полупроводник — германий.
Пространственная структура кремния представлена на рис. 3 (автор картинки — Ben Mills). Шариками изображены атомы кремния, а трубки, их соединяющие, — это каналы ковалентной связи между атомами.

Рис. 3. Кристаллическая структура кремния
Обратите внимание, что каждый атом кремния скреплён с четырьмя соседними атомами. Почему так получается?
Дело в том, что кремний четырёхвалентен — на внешней электронной оболочке атома кремния расположены четыре валентных электрона. Каждый из этих четырёх электронов готов образовать общую электронную пару с валентным электроном другого атома. Так и происходит! В результате атом кремния окружается четырьмя пристыковавшимися к нему атомами, каждый из которых вносит по одному валентному электрону. Соответственно, вокруг каждого атома оказывается по восемь электронов (четыре своих и четыре чужих).
Более подробно мы видим это на плоской схеме кристаллической решётки кремния (рис. 4).

Рис. 4. Кристаллическая решётка кремния
Ковалентные связи изображены парами линий, соединяющих атомы; на этих линиях находятся общие электронные пары. Каждый валентный электрон, расположенный на такой линии, большую часть времени проводит в пространстве между двумя соседними атомами.
Однако валентные электроны отнюдь не «привязаны намертво» к соответствующим парам атомов. Происходит перекрытие электронных оболочек всех соседних атомов, так что любой валентный электрон есть общее достояние всех атомов-соседей. От некоторого атома 1 такой электрон может перейти к соседнему с ним атому 2, затем — к соседнему с ним атому 3 и так далее. Валентные электроны могут перемещаться по всему пространству кристалла — они, как говорят, принадлежат всему кристаллу (а не какой-либо одной атомной паре).
Тем не менее, валентные электроны кремния не являются свободными (как это имеет место в металле). В полупроводнике связь валентных электронов с атомами гораздо прочнее, чем в металле; ковалентные связи кремния не разрываются при невысоких температурах. Энергии электронов оказывается недостаточно для того, чтобы под действием внешнего электрического поля начать упорядоченное движение от меньшего потенциала к большему. Поэтому при достаточно низких температурах полупроводники близки к диэлектрикам — они не проводят электрический ток.