ИРНИТУ
КАФЕДРА ХИМИИ
Отчет
по лабораторной работе (номер 3 “Определение теплоты реакции нейтрализации”)
Выполнил студент группы
Грудин Е.А.
Проверил преподаватель
Бочкарева С.С.
Цель работы: изучить основные понятия термохимии (экзо- и эндотермические реакции, тепловой эффект, энтальпия, энтальпия образования вещества), закон Гесса и следствие из закона Гесса.
Задание: провести реакцию нейтрализации и определить повышение температуры. На основании полученных данных рассчитать изменение энтальпии и тепловой эффект реакции. Выполнить требования к результатам работы, оформить отчет, решить задачу.
Теоретическое введение
Химические реакции сопровождаются выделением или поглощением энергии (чаще всего теплоты). Реакции, протекающие с выделением теплоты, называются экзотермическими, а с поглощением теплоты – эндотермическими. Количество теплоты, которое выделяется или поглощается при химической реакции, называется тепловым эффектом реакции. Тепловой эффект химической реакции обычно относят к молю продукта реакции и большей частью выражают в килоджоулях. Тепловой эффект реакции, протекающей при постоянном давлении, равен изменению энтальпии системы Δ Н. При экзотермической реакции энтальпия системы уменьшается (Δ Н <0), а при эндотермической – энтальпия системы увеличивается (Δ Н >0).
Если исходные вещества и продукты реакции находятся в стандартном состоянии, то в этом случае энтальпию реакции называют стандартной и обозначают Δ Н°.
Определение тепловых эффектов может быть осуществлено опытным путем с помощью калориметра или путем вычислений. В основе термохимических расчетов лежит закон Гесса: тепловой эффект химической реакции (т. е. изменение энтальпии Δ Н) зависит только от начального и конечного состояния участвующих в реакции веществ и не зависит от промежуточных стадий процесса.
Часто в термохимических расчетах применяют следствие из закона Гесса: энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов. Например, стандартная энтальпия реакции nА + mВ → рС + qD рассчитывается по формуле:
Δ Н° х.р. = (рΔ f Н °С + qΔ f Н° D) − (nΔ f Н° А + mΔ f Н° B),
где Δ f Н° – стандартная энтальпия образования вещества, кДж/моль.
Стандартной энтальпией образования вещества называется стандартная энтальпия реакции образования 1 моль данного вещества из простых веществ.
Выполнение работы
Любая реакция нейтрализации сильной кислоты щелочью сводится к процессу Н+ + ОН‾ → Н2О.
Для определения теплового эффекта реакции можно воспользоваться упрощенным калориметром, состоящим из трех стаканов – внешнего и двух внутренних.
В сухой внутренний стакан калориметра с помощью мерного цилиндра налить 25 мл 1 н. раствора щелочи. В другой сухой стакан налить 25 мл 1 н. раствора серной кислоты. Опустить в раствор щелочи термометр. Записать температуру и, не вынимая термометр из стакана, быстро влить кислоту в щелочь. Осторожно помешивая раствор термометром, отметить и записать максимальную температуру. Эту температуру считать конечной.
Данные опыта и результаты расчетов
| Температура Т, К | Изменение энтальпии ΔН, кДж | Δ Н° нейтр.практ., кДж/моль | ΔН°нейтр. теор., кДж/моль | ||
| начальная | конечная | ||||
Вычислить (все вычисления пояснить словами):
1. Изменение энтальпии реакции Δ Н по формуле Δ H = −V∙ ρ ∙c∙ Δ Т, где V – общий объем раствора, мл; ρ – плотность раствора, г/мл; с – теплоемкость раствора, Дж/(г∙К); Δ Т – разность между конечной и начальной температурами. Принять плотность раствора после нейтрализации равной 1г/мл, а теплоемкость его − равной теплоемкости воды, т. е. 4,18 Дж/(г∙К).
2. Тепловой эффект реакции нейтрализации Δ Н° нейтр.практ. в расчете на 1 моль эквивалентов кислоты. Так как 1 моль эквивалентов кислоты содержится в 1 л (1000 мл) раствора, а для реакции было взято 25 мл, то

3. Теоретическое значение изменение энтальпии реакции нейтрализации Δ Н° нейтр. теор для уравнения Н+ + ОН‾ → Н2О.
Энтальпии образования (Δ f Н°) для Н+, ОH‾ и Н2О соответственно равны 0; – 230,2 и –285,8 кДж/моль.
4. Относительную ошибку опыта Е (%):
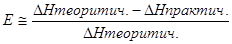
Вывод: в ходе проделанной работы, я изучил основные понятия термохимии и закон Гесса с его следствием