Периодическая система элементов.
Горизонтальный ряд хим. элементов, начинающийся щелочным металлом и заканчивающийся инертным газом, называется периодом.
I, II, III - малые периоды, т.к. состоят из одного ряда хим. элементов, имеют малое число элементов.
I - 2 элемента
|
 II
II
III
IV - VII - большие периоды, т.к. состоят из двух рядов (четного и нечетного) элементов.
В четных рядах больших периодов располагаются типичные металлы. Нечетный ряд начинается металлом, затем металлические свойства ослабляются и нарастают свойства неметаллические, заканчивается период инертным газом.
Группа - это вертикальный ряд хим. элементов, объединенных по хим. свойствам.

 Группа
Группа
 главная подгруппа побочная подгруппа
главная подгруппа побочная подгруппа
В главную подгруппу входят В побочную подгруппу входят
элементы и малых, и больших элементы только больших периодов.
периодов.


 H, Li, Na, K, Rb, Cs, Fr Cu, Ag, Au
H, Li, Na, K, Rb, Cs, Fr Cu, Ag, Au
малые большие большие
Для элементов, объединенных в одну и ту же группу, характерны следующие закономерности:
1. Высшая валентность элементов в соединениях с кислородом (за некоторым исключением) соответствует номеру группы.
Элементы побочных подгрупп могут проявлять и другую высшую валентность. Например, Cu - элемент I группы побочной подгруппы - образует оксид Cu2O. Однако, наиболее распространенными являются соединения двухвалентной меди.
2. В главных подгруппах (сверху вниз) с увеличением атомных масс усиливаются металлические свойства элементов и ослабевают неметаллические.
Строение атома.
Долгое время в науке господствовало мнение, что атомы неделимы, т.е. не содержат более простых составных частей.
Однако, в конце XIX века был установлен ряд фактов, свидетельствовавших о сложном составе атомов и о возможности их взаимопревращений.
 Атомы, представляют собой сложные образования, построенные из более мелких структурных единиц.
Атомы, представляют собой сложные образования, построенные из более мелких структурных единиц.
|
 р+ - протон
р+ - протон
|
ē - электрон - вне ядра
Для химии большой интерес представляет строение электронной оболочки атома. Под электронной оболочкой понимают совокупность всех электронов в атоме. Число электронов в атоме равно числу протонов, т.е. порядковому номеру элемента, так как атом электронейтрален.
Важнейшей характеристикой электрона является энергия его связи с атомом. Электроны, обладающие близкими значениями энергии, образуют единый электронный слой.
Каждый хим. элемент в периодической системе был пронумерован.
Номер, который получает каждый элемент, называется порядковым номером.
Физический смысл порядкового номера:
1. Каков порядковый номер элемента, таков и заряд ядра атома.
2. Столько же электронов вращается вокруг ядра.
 Z = р+ Z - порядковый номер элемента
Z = р+ Z - порядковый номер элемента
Z = 1 р+ = 1
 Z = ē
Z = ē

n0 = А - Z
n0 = А - р+ А - атомная масса элемента
n0 = А - ē
Например, Li.
 Z = 3р+ = 3
Z = 3р+ = 3
ē = 3
n0= 7-4 = 3
Физический смысл номера периода.
В каком периоде находится элемент, столько электронных оболочек (слоев) он будет иметь.

 Не +2
Не +2 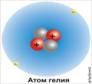
 |  |  | |||||||||||
 |  | ||||||||||||
 |  | ||||||||||||
 Li +3 Ве +4 В +5 N +7
Li +3 Ве +4 В +5 N +7
 |  |  | |||
 Определение максимального числа электронов на одной электронной оболочке:
Определение максимального числа электронов на одной электронной оболочке:
 2n2 n - номер уровня 2, 8, 18, 32
2n2 n - номер уровня 2, 8, 18, 32
Согласно этой формуле на 1 энергетическом уровне (эл. слое) могут находиться 2 ē, на 2 -ом - 8 ē, на 3-ем - 18 ē и т.д.
Типичными Ме являются те элементы, которые на внешней эл. оболочке содержат от 1 до 2 ē.
Типичные НеМе на внешней эл. оболочке содержат от 4 до 8 ē.