Инициация, т.е. сборка компонентов системы трансляции на 5'-конце мРНК, завершающаяся образованием первой пептидной связи, является важнейшей точкой приложения регуляторных воздействий на уровне трансляции. Эффективность инициации биосинтеза белка изменяется под действием различных гормонов, факторов роста и цитокинов, при изменении доступности питательных веществ и в условиях стрессовых состояний эукариотических клеток. Ключевую роль в этом играют факторы инициации трансляции eIF4E и eIF2.
Участие фактора инициации трансляции eIF4E в регуляции биосинтеза белка. Фактор eIF4E распознает кэп-структуры мРНК в составе многокомпонентного фактора инициации eIF4F, что является необходимым этапом объединения мРНК с 40S субчастицей рибосом (подробнее см. раздел 2.5.2). Фактор eIF4E лимитирует инициацию трансляции. В большинстве клеток он присутствует в количестве 0,01–0,2 молекулы/рибосому, тогда как внутриклеточное содержание других факторов находится в пределах 0,5–3 молекулы/рибосому. Внутриклеточное содержание и активность фактора eIF4E регулируются на уровне транскрипции, посттрансляционно и путем взаимодействия с белками-репрессорами.
Регуляция биосинтеза eIF4E на уровне транскрипции. В ответ на действие сыворотки или факторов роста происходит многократное возрастание внутриклеточного содержания eIF4E-мРНК. Промотор гена этого фактора содержит два сайта связывания фактора транскрипции Myc, которые функционируют в искусственных гибридных генах. В соответствии с этим повышенный уровень экспрессии гена c-myc сопровождается возрастанием внутриклеточного содержания eIF4E-мРНК. Известно, что белок Myc участвует в регуляции пролиферации клеток. Поскольку фактор eIF4E сам по себе является ключевым регулятором роста и деления клеток, полагают, что его ген может быть одной из основных мишеней регуляторного воздействия белка Myc.
Регулируемое фосфорилирование фактора eIF4E. Фософорилированное состояние полипептидной цепи фактора eIF4E коррелирует с повышенной скоростью трансляции. В митозе, характеризуемом низкой скоростью трансляции, уровень фосфорилирования eIF4E минимален. Количество фосфорилированных молекул фактора возрастает в ответ на внеклеточные воздействия гормонами, факторами роста, митогенами и цитокинами, а также в условиях повышенной нагрузки на сердце. У млекопитающих в ответ на все исследованные стимулы фосфорилирование полипептидной цепи происходит в основном в положении S209 (нумерация по полипептиду мышей). Остаток Thr в положении 210 фосфорилируется значительно реже. Поскольку в клетках, трансформированных онкогенами ras и src, наблюдается усиление фосфорилирования eIF4E, полагают, что в этом процессе участвуют MAP(ERK)-киназы (MAPK/ERK). Это участие может быть косвенным, так как в системах in vitro киназы ERK не обладают способностью фосфорилировать eIF4E. Недавно было показано, что общим субстратом протеинкиназ p38MAPK и ERK является протеинкиназа фактора eIF4E, названная MNK1 (MAP kinase interacting kinase 1), которая в активном состоянии фосфорилирована. Поскольку MNK1 эффективно и специфически фосфорилирует фактор eIF4E in vitro по остатку Ser в положении 209, ее рассматривают в качестве основного кандидата, модифицирующего этот фактор и в живой клетке, после активации каскадов реакций с участием киназ ERK и p38 MAPK.
Семейство белков-репрессоров фактора eIF4E. Недавно были обнаружены небольшие белки (молекулярная масса ~12 кДа), названные 4E-BP1, 4E-BP2 и 4E-BP3 (eIF4E-binding proteins 1, 2 and 3), ингибирующие кэп-зависимую трансляцию после прямого взаимодействия с eIF4E. Образование комплекса eIF4E–4E-BP не изменяет сродство фактора к кэп-структуре, однако предотвращает его взаимодействие с eIF4G. Белки-ингибиторы 1, 2 и фактор eIF4G обладают гомологичной последовательностью аминокислот YXXXXLΦ, где X – любая аминокислота, а Φ – алифатический аминокислотный остаток. Эта последовательность необходима для обсуждаемого белок-белкового взаимодействия.
Сродство ингибиторов семейства 4E-BP к фактору eIF4E регулируется через их фосфорилирование. Ингибитор 4E-BP1 был вначале идентифицирован как основной полипептид, фосфорилируемый под действием инсулина. Фосфорилирование полипептидных цепей ингибиторов предотвращает образование белок-белковых комплексов и происходит в присутствии гормонов (инсулин, ангиотензин, гастрин), факторов роста (EGF, PDGF, NGF,IGFI, IGFII), цитокинов (IL-3, GMCSF), митогенов (TPA) и во время аденовирусной инфекции. В то же время в клетках некоторых типов тепловой шок и полиовирусная инфекция сопровождаются снижением уровней фосфорилирования ингибиторов. Все это указывает на прямое участие ингибиторов 4E-BP в регуляции трансляции у эукариот через взаимодействие с фактором eIF4E. По крайней мере, ингибиторы 4E-BP1 и 4E-BP2 являются субстратами протеинкиназы FRAP/mTOR – очень большого белка, принадлежащего к семейству киназ PIK, родственных киназам фосфатидилинозитола. Каскад реакций, завершающихся фосфорилированием этой киназы и, в конечном счете, белковых ингибиторов трансляции, запускается в ответ на вышеупомянутые внеклеточные стимулы киназой PIK3, фосфорилирующей OH-группу фосфоинозитида в положении 3.
Фактор eIF4E в регуляции роста и пролиферации клеток. Как следует из вышеизложенного, фактор eIF4E и его белковые ингибиторы являются специфическими мишенями протеинкиназ, активируемых в ответ на внеклеточные регуляторные воздействия. Это указывает на важную роль фактора в регуляции клеточного цикла. Действительно, микроинъекция eIF4E в покоящиеся фибробласты индуцирует в них синтез ДНК, а антисмысловые РНК к мРНК фактора резко увеличивают время прохождения клеток через G1/S фазы клеточного цикла.
Сверхэкспрессия гена eIF4E приводит к характерным морфологическим изменениям в клетках HeLa и трансформирует иммортализованные клеточные линии грызунов. При этом происходит подавление апоптоза, индуцируемого в клетках истощением сыворотки. Кроме того, повышение внутриклеточного уровня фактора имеет место в опухолях различного происхождения. Все это делает фактор eIF4E объектом пристального внимания онкологов.
Фактор eIF2 как объект регуляторных воздействий. Как уже упоминалось выше, eIF2 представляет собой гетеротримерный белковый комплекс. Его α-субъединица фосфорилируется тремя известными киназами эукариот: у животных – HRI и PKR, а у дрожжей – GCN2. Фосфорилирование фактора предотвращает обмен GDP на GTP, опосредованный фактором eIF2B, и ингибирует трансляцию. Поскольку фосфорилированная форма eIF2 обладает повышенным сродством к eIF2B, последний становится эффективным конкурентным ингибитором формирования активного комплекса eIF2–GTP–Met-тРНКi.
В качестве примера изменения эффективности трансляции мРНК через фосфорилирование фактора инициации eIF2 рассмотрим механизм контроля биосинтеза гемоглобина под действием гема. Этот пример интересен также и тем, что объясняет необходимость добавления гема в бесклеточные системы трансляции, получаемые на основе белков ретикулоцитов. Более подробно бесклеточные системы трансляции описаны в разделе 7.5.
Трансляция глобиновой мРНК в бесклеточной системе биосинтеза белка из ретикулоцитов кроликов в отсутствие гемина (окисленной формы гема) сопровождается быстрым прекращением включения аминокислот в растущие полипептидные цепи, т.е. остановкой трансляции. Оказалось, что в отсутствие гемина специфическая протеинкиназа фосфорилирует фактор инициации трансляции eIF2, который в фосфорилированном состоянии прочно взаимодействует с другим фактором инициации eIF2B и в составе комплекса остается в связанном с рибосомами состоянии. В результате трансляция глобиновой мРНК останавливается. Гемин, находящийся в избытке в системе трансляции, взаимодействует с протеинкиназой и инактивирует ее. Протеинкиназа утрачивает способность фосфорилировать фактор eIF2 и, как следствие, блокировать трансляцию.
Координация синтеза глобинов на уровне трансляции происходит и в других случаях. Известно, что в диплоидной клетке человека имеются четыре активных a-глобиновых и лишь два экспрессирующихся b-глобиновых гена. Поскольку правильная сборка молекул гемоглобина предполагает участие эквимолярных количеств полипептидных цепей a- и b-глобина, необходима координация биосинтеза этих белков, которая осуществляется на уровне инициации трансляции. Оказывается, a-глобиновая мРНК конкурирует с b-глобиновой мРНК за факторы инициации трансляции, однако b-глобиновая мРНК обладает большим сродством к факторам, что приводит к более высокой эффективности ее трансляции по сравнению с a-глобиновой мРНК. Предполагается, что в качестве фактора инициации трансляции, ответственного за предпочтительную трансляцию b-глобиновой мРНК, выступает кэп-связывающий белок.
Вышеописанные примеры показывают, как изменяется эффективность инициации трансляции определенных мРНК рибосомами при непосредственном воздействии на факторы инициации. Имеются и другие механизмы регуляции эффективности трансляции и, в конечном счете, регуляции экспрессии генов, реализующие свое действие через изменение эффективности инициации трансляции мРНК. Среди факторов, влияющих на эти механизмы, следует упомянуть, во-первых, разную эффективность ("силу") 5’-концевых областей инициации трансляции TIR (в частности последовательности Шайна–Дальгарно), необходимых для связывания рибосом в процессе образования инициаторного комплекса. Такие последовательности обеспечивают требуемую скорость трансляции соответствующих мРНК (подробнее см. раздел 7.2.6). Во-вторых, регуляция скорости инициации трансляции возможна за счет влияния пространственной структуры 5’-концевого инициаторного района мРНК. Сворачивание этой части мРНК в стабильную пространственную структуру блокирует трансляцию. В-третьих, эффективная регуляция инициации трансляции определенных мРНК достигается за счет специфического взаимодействия инициаторных участков мРНК с белками-регуляторами, которые в данном случае выступают репрессорами инициации трансляции.
Белки, взаимодействующие с мРНК, как регуляторы трансляции. Большинство регуляторных белков, взаимодействующих с 5’-концевыми TIR-последовательностями мРНК прокариот, являются негативными регуляторами трансляции. Классический пример такой регуляции экспрессии генов дают рибосомные белки E. coli – репрессоры собственного синтеза, которые предотвращают взаимодействие 30S субчастиц рибосом со своими мРНК. Оригинальный механизм репрессии использует рибосомный белок S15, который, взаимодействуя с TIR-последовательностью своей мРНК, стабилизирует предсуществующий псевдоузел. В результате SD-область мРНК становится ловушкой для 30S субчастицы рибосом, которая взаимодействует с ней, но не может инициировать синтез белка.
Аналогичные механизмы функционируют и у эукариот. В этом отношении хорошо изучена регуляция трансляции мРНК ферритина, синтазы δ-аминолевулиновой кислоты и субъединицы b сукцинатдегидрогеназы позвоночных животных. 5’UTR мРНК этих белков содержат регуляторный элемент IRE (iron-responsive element), с которым взаимодействует белок IRP (iron-regulatory protein), акцептирующий ионы железа. В отсутствие железа IRP связывается с IRE и блокирует трансляцию мРНК. Сродство IRP к IRE понижается в 50–100 раз, если он находится в комплексе с ионами железа. Этого оказывается достаточно для вовлечения соответствующих мРНК в трансляцию.
Цитоплазматические мРНК, не участвующие в синтезе белка в составе полисом, образуют нетранслируемые мРНП-комплексы. Кроме уже рассмотренных выше регуляторных белков, распознающих определенные последовательности мРНК конкретных видов, два белка обнаруживаются во всех мРНП в большом количестве: поли(А)-связывающий белок PABP (p70) и белок р50 с молекулярной массой ~50 кДа. Роль белка PABP в стабилизации мРНК и инициации трансляции уже обсуждалась. Теперь же целесообразно рассмотреть регуляторные функции белка p50.
Белок p50, ассоциированный с цитоплазматическими мРНП-частицами. В отличие от белка PABP, преимущественно ассоциированного с функционирующими полисомами, белок p50 является основным компонентом как неактивных мРНП, так и участвующих в синтезе белка. Белок p50 ретикулоцитов кроликов обнаруживает до 98% гомологии с факторами транскрипции животных, взаимодействующими с так называемым Y-боксом, цис- действующей регуляторной последовательностью ДНК CTATTGGC/TC/TAA. Факторы этого семейства преимущественно связывают одноцепочечную и апуринизированную ДНК, трехцепочечную H-ДНК и РНК.
Отмечена двойственная роль белка p50 в регуляции трансляции: он может выступать как ингибитор и как активатор биосинтеза белка. При высоком отношении p50/мРНК (5–10 молекул белка на молекулу мРНК) имеет место ингибирование трансляции, при низком (до четырех молекул p50 на молекулу мРНК) – активация. Ингибирующая функция белка обнаружена при депонировании мРНК в ооцитах, а также в условиях сверхэкспрессии p50 в соматических клетках. Возможно, при высоких концентрациях белка происходит освобождение его С-концевых частей от контактов с РНК, приводящее к мультимеризации белка и переходу мРНП в конденсированное состояние.
Альтернативно, белок p50 выступает в качестве фактора трансляции в полисомах, активно синтезирующих белок. Полагают, что в этом случае он может облегчать инициацию трансляции, предотвращая неспецифическое взаимодействие мРНК с факторами трансляции, а также обеспечивая формирование у мРНК оптимальной пространственной структуры. Поскольку у p50 обнаружена РНК-расплетающая активность, он может способствовать сканированию 5’UTR мРНК прединициационным комплексом.
Антисмысловые РНК как регуляторы трансляции. Прокариотические антисмысловые РНК длиной 70–110 нт образуют структуры типа "стебель–петля", в которых стебель защищает эти РНК от деградации, а петля длиной шесть–восемь нт служит для первоначального взаимодействия с мРНК-мишенью. После образования комплексов РНК–РНК наблюдали изменение стабильности мРНК, эффективности процессинга РНК-мишени, терминации транскрипции или инициации их трансляции. Из этого видно, что антисмысловые РНК являются мощными природными модуляторами экспрессии генов у прокариот. Данные о возможном участии природных антисмысловых РНК в регуляции трансляции у эукариот противоречивы.
Короткие ОРС в 5’-концевых лидерных последовательностях РНК как регуляторы трансляции. Около 10% мРНК растений содержат в своих 5’-концевых лидерных последовательностях более одного AUG-кодона. Некоторые из них удаляются с помощью альтернативного сплайсинга. Другие возникают в результате использования РНК-полимеразами альтернативных промоторов при инициации транскрипции соответствующих генов. Присутствие коротких ОРС в лидерных последовательностях мРНК, как правило, сопровождается снижением эффективности трансляции таких матриц. Функционирование этого механизма обнаружено в клетках млекопитающих, растений и дрожжей. Влияние коротких ОРС на трансляцию расположенных ниже последовательностей нуклеотидов мРНК недавно было детально исследовано с использованием искусственных генно-инженерных конструкций, в которых изменяли длину и число потенциальных сайтов инициации трансляции, предшествовавших генам-репортерам. Оказалось, что ингибирующее действие коротких ОРС возрастает с увеличением их длины. Даже одиночный AUG-кодон, снижает уровень трансляции ниже расположенных последовательностей, по крайней мере, в два раза. Короткие ОРС промежуточной длины (~30 кодонов) обладали пятикратным ингибирующим действием, а протяженные ОРС (>100 кодонов) полностью подавляли трансляцию следующих за ними последовательностей. Механизм ингибирующего действия коротких ОРС связан с тем, что они транслируются. Это снижает вероятность инициации трансляции на инициирующих кодонах, расположенных вслед за ними, поскольку процесс реинициации трансляции требует вхождения новых факторов инициации трансляции в инициаторный комплекс, включающий рибосому.
Трансактивация трансляции полицистронных РНК у вирусов. Предшественники геномной РНК вируса мозаики цветной капусты, а также их производные, подвергнутые альтернативному сплайсингу, являются полицистронными мРНК для многих вирусных белков. ОРС сближены друг с другом, и их не разделяют протяженные межцистронные последовательности. Такие РНК содержат внутренние AUG-кодоны, которые неэффективно используются для инициации трансляции в протопластах или трансгенных растениях, однако начинают функционировать в присутствии вирусных генов-трансактиваторов (TAV) (рис. I.40,д). В частности, трансактиваторная функция
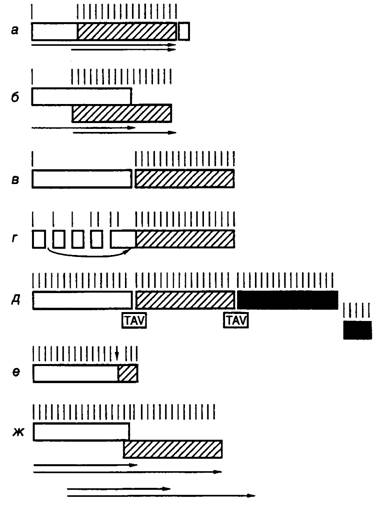
Рис. I.40. Механизмы трансляции полицистронных мРНК у вирусов растений
Черные, серые и светлые прямоугольники изображают различные ОРС в полицистронных РНК, вертикальные линии над ними – AUG-кодоны, горизонтальные стрелки указывают направление перемещения рибосом во время шунта, вертикальная стрелка указывает положение частично супрессируемого стоп-кодона, TAV – гены-активаторы
а, б, в – примеры ослабленного сканирования полицистронных мРНК, содержащих: а – два сайта инициации трансляции на одной ОРС (вирус мозаики вигны (cowpea)), б – перекрывающиеся ОРС (вирус желтой мозаики турнепса), в – две последовательно расположенные ОРС (вирус скрытой мозаики сливы); г – схема шунтирования сайтов инициации (вирус мозаики цветной капусты); д – трансактивация последовательно расположенных ОРС (тот же вирус); е – частичная супрессия стоп-кодона (вирус мозаики табака); ж – сдвиг рамки считывания (вирус желтой карликовости ячменя)
была показана для ОРС IV вируса CaMV и конкретных ОРС многих других вирусов растений. Кодируемый этим геном белок TAV специфически стимулирует трансляцию внутренних ОРС. В искусственных РНК трансактивация оказывается особенно эффективной, если в первой ОРС присутствует ~30 кодонов. Трансактивацию наблюдали для нескольких ОРС, которые были расположены ниже короткой первой рамки считывания. О том, что трансактивация происходит на уровне реинициации трансляции, свидетельствовали полярные эффекты вставок в такие полицистронные РНК последовательностей со вторичной структурой типа шпилек. Поскольку эффективность трансактивации зависела от длины первой ОРС, был сделан вывод, что трансактиватор действует прямо или косвенно на элонгирующие (или терминирующие) рибосомы. Оптимальная длина первой ОРС в 30 кодонов обеспечивает синтез пептида, длины которого достаточно для появления на поверхности транслирующей рибосомы. Предполагают, что на последующем этапе трансляции происходят структурные изменения рибосом, которые приводят к потере способности рибосом к реинициации трансляции и, как следствие, к трансактивации рибосом.
Функция трансактивации связана с центральной частью полипептидной цепи TAV. В процессе трансляции TAV взаимодействует с полисомами, а также с рибосомным белком (молекулярная масса 18 кДа) клеток дрожжей и растений. Трансгенные растения Arabidopsis и табака, экспрессирующие белок TAV, обладают ненормальным фенотипом и пониженной жизнеспособностью. Однако в настоящее время неясно, является ли это следствием способности белка обеспечивать трансактивацию трансляции или сопряжено с его другими, неизвестными активностями.