В заключение рассмотрим еще одно неожиданное направление белковой инженерии, четко обозначившееся в самое последнее время. Во всех вышеупомянутых подходах конструирование белков с новыми свойствами основано на использовании молекулярно-генетических методов направленного мутагенеза. К сожалению, все эти методы обладают одним существенным недостатком: с их помощью невозможно осуществить встраивание в исследуемые полипептидные цепи многих неприродных аналогов аминокислот или других химических соединений, что весьма существенно ограничивает возможности структурно-функциональных исследований белков. Такие модификации можно было бы вносить в процессе химического синтеза пептидов, однако в этом случае невозможно получать пептиды большой длины (как правило, >40 остатков аминокислот) из-за накопления побочных продуктов синтеза, что затрудняет последующую очистку основного продукта и снижает выход пептидов.
Недавно был разработан альтернативный подход к химическому синтезу длинных пептидов, заключающийся в ферментативном лигировании предварительно синтезированных химическими методами коротких пептидов друг с другом. Этот подход стал возможен благодаря созданию с помощью направленного мутагенеза аналога субтилизина, так называемого субтилизина BPN’, катализирующего образование пептидных связей в водных растворах. Такой мутантный фермент, получивший название субтилигазы, содержит в своей полипептидной цепи две мутационные замены: Ser заменен на остаток Cys, а Pro – на Ala. Первая замена в активном центре субтилизина резко повышает его способность к аминолизу (т.е. образованию пептидной связи) по сравнению с гидролитической активностью при использовании в качестве субстратов тетрапептидных эфиров. Вторая мутация изменяет конформацию мутантного активного центра, компенсируя стерические эффекты, вызванные введением остатка Cys, что еще более улучшает каталитические свойства фермента.
Д. Джексоном с соавторами (1994 г.) разработана стратегия синтеза крупных полипептидных цепей с использованием субтилигазы, реализованная в синтезе модифицированной рибонуклеазы А, обладающей ферментативной активностью. На первом этапе синтеза был получен полностью незащищенный пептид, представляющий собой C-концевой фрагмент РНКазы А, и он был использован в дальнейшем в качестве акцепторной молекулы (см. схему).
R-NH-пептидY-CO-R’ + H2N-пептидZ-COOH
¯ 1. Субтилигаза
R-NH-пептидY-CO-NH-пептидZ-COOH
¯ 2. Zn/CH3COOH
H2N-пептидY-CO-NH-пептидZ-COOH
R-NH-пептидX-CO-R’ ¯ 3. Повторение этапов 1 и 2
H2N-пептидX-CO-NH-пептидY-CO-NH-пептидZ-COOH
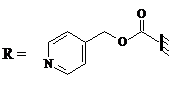
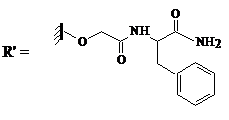
| 
|
| Изоникотиноил | Гликолат-фенилаланиламид (glc-F-NH2); |
X, Y, Z – различные пептиды
Следующий N-концевой донорный фрагмент полипептидной цепи этерифицирован по С-концу гликолат-фенилаланиламидом (glc-F-NH2). Полученный эфир эффективно ацилируется субтилигазой, что отражает особенности ее субстратной специфичности: фермент предпочитает использовать в качестве субстрата эфиры, в которых освобождается группа glc-F-NH2. В отличие от этого донорный пептид содержит на N-конце дополнительную изоникотиноильную защитную группу, что предотвращает его лигирование самого на себя. Такая группа вводится на последней стадии твердофазного синтеза пептидов и проявляет устойчивость к разбавленной плавиковой кислоте (HF), которая использовалась для снятия защиты с боковых цепей пептидов и отщепления самих пептидов от твердого носителя. После каждого лигирования пептидов изоникотиноильную группу удаляли в условиях мягкого восстановления (в присутствии цинка и уксусной кислоты) для освобождения NH2-группы – необходимой участницы очередного цикла лигирования.
Исходя из субстратной специфичности субтилигазы (фермент эффективно использует крупные гидрофобные донорные субстраты и малоэффективен с отрицательно заряженными остатками аминокислот или остатками пролина, попадающими в его активный центр), карту полипептидной цепи РНКазы А разделили на шесть фрагментов. Эти фрагменты были синтезированы и лигированы друг с другом в соответствии с вышеприведенной схемой с выходом, достигающим 70% на каждом этапе. В результате была получена полноразмерная полипептидная цепь РНКазы А (124 аминокислотных остатка), которая после спонтанного фолдинга приобрела искомую ферментативную активность. В ходе синтеза отдельных пептидов исследователи заменили два остатка His, находящихся в активном центре фермента (положения 12 и 119), на остатки 4-фторгистидина. Поскольку это производное His обладает pKa = 3,5 (pKa His = 6,8), у искусственной РНКазы А наблюдали резкий сдвиг в оптимуме pH реакции гидролиза субстрата без заметных изменений kкат, что было особенно неожиданным результатом, позволившим сделать интересные выводы о механизме ферментативной реакции, осуществляемой РНКазой А. Позднее субтилигаза была успешно использована для синтеза модифицированного гормона роста человека и циклических пептидов.
Значение результатов, полученных в ходе направленного изменения субстратной специфичности субтилизина, превратившегося в субтилигазу, выходит далеко за рамки чисто прикладного использования нового искусственного фермента. Это и многие другие подобные исследования, осуществленные методами белковой инженерии, однозначно указывают на возможность изменения субстратной специфичности известных ферментов путем замены в них одного или нескольких критических аминокислотных остатков. Такого рода результаты, примеры которых уже были приведены выше и более подробно будут рассмотрены в следующем разделе, приподнимают завесу над механизмами молекулярной эволюции метаболических путей живого организма, лежащих в основе его существования. История развития молекулярной биологии и генетики показывает, что практически любой неизвестный в природе механизм, разработанный и реализованный исследователем в физиологических условиях в пробирке, уже используется in vivo в существующих генетических системах. Однажды на семинаре, когда кто-то пытался выдать банальность за новую информацию, Р.Б. Хесин сказал: "Это новость только для того, кто не читает научной литературы". Мы записаны в библиотеку Природы, однако, несмотря на все усилия, в настоящее время в состоянии читать на разных языках только букварь, написанный под ее диктовку. Вся область белковой инженерии, которая, на первый взгляд, кажется блестящим порождением лишь одного интеллекта человека, не есть исключение, поскольку ферменты с новой субстратной специфичностью могут быть результатом точковых мутаций, непрерывно происходящих в геноме любого живого организма. А следовательно, Природа непрерывно конструирует новые белки и отбирает лучшие варианты с самого момента возникновения жизни на Земле. И этот процесс ежеминутно происходит в биосфере, в том числе и в онтогенезе эукариот.
Концепция ксенобиоза
Успехи белковой инженерии, демонстрирующие возможность изменения субстратной специфичности ферментов путем замены одной или нескольких аминокислот с помощью направленного мутагенеза, наводят на многочисленные размышления. В частности, возникает вопрос: почему изменения субстратной специфичности ферментов являются редким событием, а мутации в конкретном гене, как правило, сопровождаются ослаблением или потерей ферментативной активности вообще? В силу ограниченности наших знаний о структурно-функциональных взаимоотношениях в белках ответ на такой вопрос кажется очевидным: одиночные замены аминокислот в активном центре фермента или его окрестностях приводят к конформационным или иным изменениям полипептидной цепи, делающим активный центр нефункциональным в отношении своего природного субстрата.
Вероятно, на самом деле последствия таких мутационных замен аминокислот могут быть более значительными. Начнем с того, что внимание исследователей, изучающих свойства мутантных ферментов, как правило, целиком направлено на изучение влияния мутаций на его основную активность. При этом не учитывается возможность появления новой ферментативной активности, которая остается незамеченной просто потому, что исходно неизвестно, появления какой активности следует ожидать. А между тем при ближайшем рассмотрении такие последствия почти любой миссенс-мутации (точковой мутации, которая приводит к замене одного осмысленного кодона на другой) в структурной части гена, кодирующего полипептидную цепь, кажутся весьма вероятными. Действительно, в природе, по-видимому, не существует ферментов с абсолютной субстратной специфичностью, и полифункциональность является изначальным и фундаментальным свойством сложных полипептидов. Какой бы узкой ни была субстратная специфичность ферментов по отношению к природным субстратам, для них всегда можно синтезировать искусственные субстраты, расширяющие их субстратную специфичность. Полифункциональность описана для многих природных белков. Например, кристаллины (одни из основных белков хрусталика глаза позвоночных) у млекопитающих являются одновременно малым белком теплового шока неизвестной функции, у птиц и рептилий обладают активностью аргининосукцинатлиазы, другая же форма (d) у рыб и рептилий обладает лактатдегидрогеназной активностью и является ДНК-связывающим белком. Изоформа кристаллинов t, характерная для рыб, птиц и рептилий, является одновременно a-энолазой и белком теплового шока. У гемоглобина – основного переносчика кислорода и углекислого газа животных, обнаружены анилингидроксилазная, каталазная и пероксидазная активности. Все вышеперечисленные активности гемоглобина, по-видимому, не имеют физиологического значения и могли возникнуть именно как побочные активности в процессе эволюционирования основной функции этого белка.
Еще более яркий пример такого рода демонстрируют абзимы (антитела, обладающие ферментативной активностью). Помимо хорошо известной гидролитической активности абзимов в отношении различных эфиров и кокаина описана их способность осуществлять синтез амидов, реакции стереоспецифической циклизации, перегруппировку Клайзена, приводящую к образованию префеновой кислоты из хоризмовой, а также ряд других реакций. Сколько же потенциальных ферментативных активностей заключено во всей популяции антител одного индивидуума, репертуар которых практически безграничен благодаря запрограммированному процессу соматического мутагенеза?!
Исходя из этого можно ожидать появления в организме человека и животных антител, обладающих самыми неожиданными ферментативными активностями, гены большей части которых элиминируются в процессе эмбрионального развития. Подтверждением данного предположения служит открытие в организме больных астмой аутоиммунных антител, специфически расщепляющих эндогенно образующийся пептидный гормон – вазоактивный кишечный пептид (VIP). По-видимому, по мере накопления экспериментальных данных число таких примеров будет увеличиваться. На скрытую потенциальную полифункциональность полипептидных цепей указывает также наличие у многих ферментов аллостерической регуляции, проявляющейся в различных формах, разная субстратная специфичность аллельных вариантов различных ферментов, а также изменение субстратной специфичности некоторых ферментов при изменении условий окружающей среды.
Таким образом, при ближайшем рассмотрении традиционное представление о ферментах как о высокоспецифических биологических катализаторах кажется упрощенным. Высокая специфичность ферментов проявляется лишь в определенных условиях внутренней среды организма, как одна из возможностей, детерминированных конкретной первичной структурой данного полипептида. Незначительные изменения первичной структуры таких полипептидных цепей под действием точковых мутаций, по-видимому, могли бы способствовать проявлению скрытых возможностей полипептидных цепей, вызывая появление у них новой субстратной специфичности. Реализация некоторых вновь возникших субстратных специфичностей мутантных ферментов может происходить в клетках в том случае, если для них найдется соответствующий субстрат среди многочисленных нормальных метаболитов и не менее многочисленных макромолекул (что имеет место, в частности, в случае аутоиммунных антител, расщепляющих VIP).
Таким образом, вырисовывается следующая гипотетическая цепь событий, приводящих к образованию ферментов с новой субстратной специфичностью: соматическая мутация изменяет первичную структуру полипептидной цепи какого-либо фермента таким образом, что он начинает распознавать эндогенный метаболит в качестве нового субстрата и метаболизировать его с образованием нового химического соединения, не свойственного данному организму. Эндогенно синтезированному химическому соединению можно было бы присвоить парадоксальное название эндогенного ксенобиотика. Естественно, что мутационное изменение субстратной специфичности ферментов должно быть редким событием. Однако с учетом громадного числа соматических клеток организмов животных и человека, а также вполне значимой частоты спонтанных соматических мутаций (10-8–10-9 и выше на клеточную генерацию) этот механизм может реализовываться.
Возможность такого события должна существенно возрастать из-за увеличения частоты соматических мутаций под действием неблагоприятных экологических факторов. Более того, вышеупомянутые низкие частоты соматических мутаций можно рассматривать только как средние. В разделе 5.3 уже была обоснована дифференциальная защищенность отдельных генетических локусов от химических мутагенов, которая обусловливается особенностями их пространственной структуры в составе хроматина.
Если предположение об образовании эндогенных ксенобиотиков в онтогенезе верно, то подобный процесс должен быть свойственен большинству многоклеточных организмов и носить глобальный характер. В соответствии с этой гипотезой процесс образования эндогенных ксенобиотиков в многоклеточном организме ферментами, субстратная специфичность которых изменена под действием соматических мутаций, можно было бы назвать ксенобиозом. Какими же могут быть последствия ксенобиоза для многоклеточного организма? В качестве единственного примера рассмотрим возможное влияние соматических мутаций на систему цитохрома P-450 в организме человека и животных.
Цитохромы группы P-450 являются одними из основных компонентов обширной системы детоксикации чужеродных химических соединений (ксенобиотиков), поступающих в организм человека и животных из окружающей среды (подробнее см. раздел 5.1.1). Отличительной особенностью системы цитохромов P-450 является их способность распознавать в качестве субстратов и метаболизировать множество экзогенных химических соединений, что, с одной стороны, объясняется наличием большого числа изоформ цитохромов P-450, а с другой – их широкой субстратной специфичностью.
Среди цитохромов P-450 встречаются изоформы и со строгой субстратной специфичностью. Эти ферменты участвуют в метаболизме эндогенных химических соединений, в частности в биосинтезе стероидных гормонов. Таким образом, налицо противоречивый характер действия цитохромов группы P-450. С одной стороны, они распознают и метаболизируют миллионы ксенобиотиков, а с другой – как правило, не метаболизируют сотни тысяч эндогенных метаболитов. Следовательно, система цитохрома P-450 толерантна в отношении эндогенных метаболитов собственного организма, многие из которых обладают большим структурным сходством с экзогенными ксенобиотиками. Каким же образом можно представить себе механизм потери толерантности системы цитохрома Р-450 по отношению к обычным метаболитам соматических клеток, и каковы возможные последствия этого явления? Метаболизм ксенобиотиков цитохромами группы P-450 сопровождается двойственным физиологическим эффектом. Во-первых, как уже упоминалось (см. раздел 5.1.1), происходит детоксикация ксенобиотиков, а во-вторых, их метаболическая активация – образование нестабильных, реакционноспособных промежуточных химических соединений, обладающих мутагенной и канцерогенной активностью. Этот механизм является одним из основных в активации химических проканцерогенов в канцерогены, особенно в случае полициклических ароматических углеводородов.
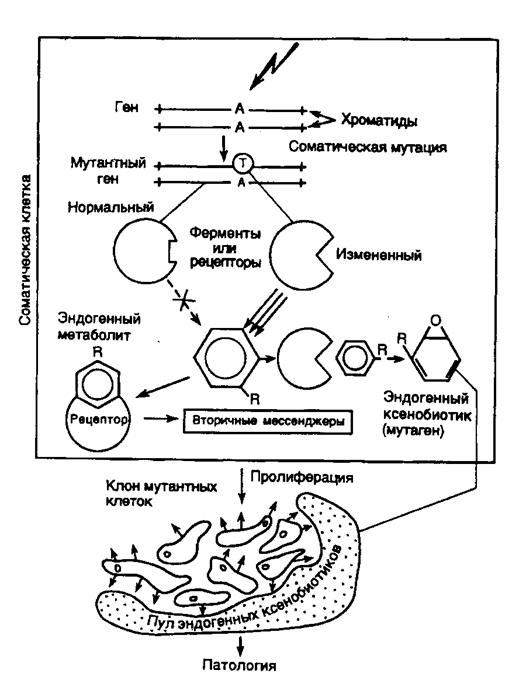
Рис. II.24. Гипотетическая схема ксенобиоза и его последствий
В верхней части рисунка изображены соматическая клетка и происходящие в ней процессы, приводящие к образованию эндогенных ксенобиотиков
При этом можно говорить о возможности нарушения толерантности системы цитохрома Р-450 в результате каких-либо патологических процессов, как это имеет место в случае иммунной системы при развитии аутоиммунных заболеваний. С учетом приведенных фактов можно предполагать, что под действием соматических мутаций может произойти изменение активного центра цитохрома P-450 таким образом, что он начнет распознавать в качестве субстрата эндогенный метаболит организма, например ароматическую аминокислоту или стероидный гормон, и метаболизировать его по эпоксид-диольному пути с образованием промежуточного эпоксида, обладающего мутагенной активностью (рис. II.24). Образовавшийся эндогенный ксенобиотик в том случае, если он не окажется особенно токсичным, будет непрерывно мутагенизировать геном как своей собственной клетки, так и соседних клеток до тех пор, пока не произойдут мутации, нарушающие контроль клеточной пролиферации (например в онкогенах или генах-супрессорах опухолей), что будет сопровождаться малигнизацией клеток, в том числе их неконтролируемым ростом, т.е. развитием злокачественного новообразования.
В том случае, если будет малигнизироваться клетка, содержащая мутантный ген цитохрома P-450, то все клетки образующейся опухоли будут синтезировать эндогенный ксенобиотик и опухоль будет оказывать сильный токсический эффект на целый организм. Этого не произойдет, если будут малигнизироваться клетки, расположенные по соседству с мутантной. В настоящее время уже описаны эксперименты, в которых с помощью направленного введения точковых мутаций удалось изменить специфичность цитохрома P-450. Кроме того, как было упомянуто выше, изменение субстратной специфичности под действием точковых мутаций описано и для других ферментов. Все это указывает на возможность развития событий по предлагаемому гипотетическому сценарию.
Появление мутаторного фенотипа у клеток злокачественных новообразований описано в настоящее время для многих форм рака. Основной причиной мутаторного фенотипа раковых клеток считают мутационные нарушения ферментных систем репарации, что имитирует внутриклеточное возрастание концентрации мутагенов. Предлагаемый механизм указывает на еще один возможный путь малигнизации нормальных клеток через образование эндогенных ксенобиотиков – эндогенных мутагенов. При развитии такой цепи событий повреждение систем репарации будет вторичным по отношению к первичному синтезу эндогенного мутагена.
Помимо онкологических заболеваний эндогенные ксенобиотики могли бы вызывать некоторые аутоиммунные заболевания в ответ на образование аддуктов с макромолекулами организма, что придавало бы модифицированным макромолекулам иммуногенность и нарушало иммунологическую толерантность организма. Эндогенные ксенобиотики могли бы быть также одной из постоянно действующих причин старения организма вследствие его постепенного отравления эндогенными ксенобиотиками по мере накопления в клетках с возрастом мутантных ферментов, обладающих измененной субстратной специфичностью.
Процесс спонтанного и индуцированного соматического мутагенеза происходит непрерывно на протяжении всей жизни многоклеточного организма. Следовательно, в организме постоянно образуются новые мутантные белки, которые исходно не были закодированы его геномом. Мутантные белки могут контактировать в клетках с большим количеством эндогенных метаболитов и при наличии структурного соответствия между метаболитом и новым активным центром мутантного белка метаболизировать его с образованием эндогенного ксенобиотика, например продуктов расщепления упомянутого выше пептидного гормона VIP, наличие которых в организме больных доказано. Многоклеточный организм является своеобразным полигоном, на котором ежеминутно на протяжении всей жизни происходят испытания вновь образующихся белков на способность метаболизировать эндогенные химические соединения, с которыми они находятся в контакте. Таким образом, ксенобиоз в том случае, если он распространен так широко, как я думаю, должен быть обычным феноменом, присущим всем многоклеточным организмам.
Если предположение о ксенобиозе верно, то организм должен обладать эффективными системами защиты от этого неизбежного явления. Помимо высокоэффективных репаративных систем, понижающих частоту спонтанного мутагенеза в соматических клетках, защиту от эндогенных ксенобиотиков отчасти могла бы осуществлять сама иммунная система. В таких случаях с участием иммунной системы элиминировались бы те мутантные соматические клетки, которые экспонируют мутантные белки на своей поверхности и которые в этом случае распознавались бы как чужеродные антигены. Однако в большинстве случаев, по-видимому, этого не должно происходить, так как мутантные белки будут локализованы внутри клеток.
Другим средством защиты от образующихся ферментов с новой субстратной специфичностью (и ксенобиоза) у многоклеточных организмов могут быть убиквитин- и ATP-зависимые системы внутриклеточного протеолиза аномальных белков. Однако эти системы должны срабатывать в первую очередь в отношении мутантных белков, у которых резко нарушена пространственная структура, что при одиночных заменах аминокислот, по-видимому, происходит редко. В пользу такого предположения свидетельствуют все те многочисленные мутантные соматические клетки, которые описаны в литературе и из которых можно выделять мутантные белки.
Вероятно, основную защиту от эндогенных ксенобиотиков могла бы обеспечивать обсуждавшаяся выше система цитохрома P-450. Действительно, широкая совокупная субстратная специфичность системы цитохрома P-450 позволяет ей метаболизировать и в конечном счете обезвреживать химические соединения. По аналогии с иммунной системой, которая помимо защиты организма от экзогенных инфекционных агентов выполняет функции иммунного надзора за антигенным состоянием соматических клеток, основной функцией системы цитохрома P-450 может быть освобождение организма от эндогенных ксенобиотиков. В соответствии с этим система цитохрома P-450 эволюционно могла возникнуть для поддержания, прежде всего, метаболического гомеостаза многоклеточных организмов в условиях непрерывно образующихся эндогенных ксенобиотиков, а уже затем ее функции распространились и на экзогенные химические соединения, вредные для организма.