Одним из наиболее очевидных достоинств перманганата калия является интенсивная фиолетовая окраска, которая обычно служит индикатором при титровании. Чтобы придать заметную окраску 100 мл воды, достаточно всего лишь 0,01-0,02 мл 0,02 М (0,1 н.) раствора. В случае очень разбавленных растворов перманганата конечную точку устанавливают по изменению окраски комплекса железа(II).
Окраска перманганата в конечной точке неустойчива и постепенно обесцвечивается в результате взаимодействия избытка перманганата с ионом марганца(II), присутствующим в конечной точке в относительно большом количестве:
MnО42- + ЗMn 2+ + 2Н2О↔5 MnО2 (тв.) + 4Н+ (5)
Константа равновесия этой реакции (ее легко рассчитать из стандартных потенциалов двух полуреакций) имеет значение порядка 1047. Таким образом, даже в сильно кислом растворе концентрация перманганата, сосуществующего в равновесии с ионом марганца (II), мала. К счастью, скорость установления этого равновесия тоже мала, поэтому окраска в конечной точке ослабляется постепенно.
Интенсивная окраска раствора перманганата осложняет измерение объемов реагента в бюретке. На практике часто более удобно за точку отсчета принимать поверхность жидкости, а не нижнюю часть мениска.
4. Экспериментальная часть
Определение Fe2+ в керамических изделиях
В коническую колбу вместимостью 250 мл наливают 100 мл серной кислоты (1:4) добавляем известную навеску измельченного черепка и кипятим в защитной атмосфере углекислого газа.
Колбу закрывают пробкой с двумя отверстиями, в которые вставлены стеклянные трубки, согнутые под прямым углом. Одна из трубок (по ходу газа) доходит до дна колбы, вторая кончается под пробкой. Длинную трубку присоединить к биологической пробирке с СaCO3. Прилив к мрамору соляной кислоты, пропускают поток углекислого газа через колбу в течение 3 мин.
В это время отвешивают на сухом часовом стекле 1-1,5 г навески материала, находящегося в воздушно-сухом состоянии. Приоткрыв пробку, быстро всыпают навеску в колбу. Не прекращая тока газа, взвешивают стекло и по разности определяют массу навески. Содержимое колбы кипятят 30 мин, пропуская при этом ток углекислого газа. Затем снимают колбу с плитки и, не прекращая тока газа, охлаждают содержимое колбы.
После снимают пробку, прибавляют 150 мл свежепрокипяченной холодной воды и титруют раствором марганцовокислого калия (перманганатом калия) до розового цвета, не исчезающего в течение 20 - 30 с. Метод основан на кислотном разложении анализируемой пробы в потоке углекислого газа с последующим титрованием двухвалентного железа перманганатом калия).
Расчеты, полученные в результате опыта
· Керамика №22 (неолит (с 6 - по 2 тыс. до н. э.) ст. Дедин) (темного цвета)
V1 = 2,52 мл
V2 = 2,56 мл
V3 = 2,54 мл.
Vср = 2,54 мл.
Сн(Fe2+) = 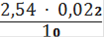
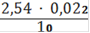 = 0,005588
= 0,005588
См(Fe2+) = 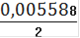
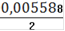 = 0,002794(Fe2+) = 0,002794 ∙ 0,25= 0,0006985(Fe2+) = 0,0006985 ∙ 55,845 = 0,0390(Fe2+)=
= 0,002794(Fe2+) = 0,002794 ∙ 0,25= 0,0006985(Fe2+) = 0,0006985 ∙ 55,845 = 0,0390(Fe2+)= 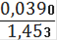
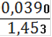 ∙ 100% = 2,7%(Fe2O3) = 3,86%
∙ 100% = 2,7%(Fe2O3) = 3,86%
· Керамика №16 (кон. 2 - нач. 1 тыс. до н.э.) (светло-коричневого цвета)
V1 =1,05 мл
V2 = 1,07 мл
V3 = 1,07 мл.
V4 = 1,06 мл
Vср = 1,06 мл
Сн(Fe2+) = 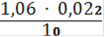
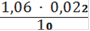 = 0,002332
= 0,002332
См(Fe2+) = 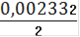
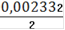 = 0,001166(Fe2+) = 0,001166 ∙ 0,25= 0,0002915(Fe2+) = 0,0002915 ∙ 55,845 = 0,01628(Fe2+)=
= 0,001166(Fe2+) = 0,001166 ∙ 0,25= 0,0002915(Fe2+) = 0,0002915 ∙ 55,845 = 0,01628(Fe2+)= 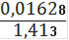
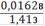 ∙ 100% = 1,15%(Fe2O3) = 1,64%
∙ 100% = 1,15%(Fe2O3) = 1,64%
· Керамика №14 (неолит (с 6 - по 2 тыс. до н. э.)Черное). (светло-коричневого цвета с черными пятнами)
V1 = 1,64 мл
V2 = 1,66 мл
V3 = 1,67 мл.
Vср = 1,66 мл
Сн(Fe2+) = 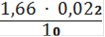
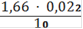 = 0,00365
= 0,00365
См(Fe2+) = 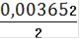
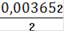 = 0,001826(Fe2+) = 0,001826 ∙ 0,25= 0,0004565(Fe2+) = 0,0004565 ∙ 55,845 = 0,0255(Fe2+)=
= 0,001826(Fe2+) = 0,001826 ∙ 0,25= 0,0004565(Fe2+) = 0,0004565 ∙ 55,845 = 0,0255(Fe2+)= 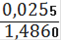
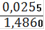 ∙ 100% = 1,72%(Fe2O3) = 2,46%
∙ 100% = 1,72%(Fe2O3) = 2,46%
· Керамика №13 (неолит (с 6 - по 2 тыс. до н. э.)Рудня-1) (на внешнем слое светло коричневого цвета, внутренний слой темно-серый)
V1 = 0,71 мл
V2 = 0,69 мл
V3 = 0,69 мл.
V4 = 0,70 мл
Vср = 0,698 мл
Сн(Fe2+) = 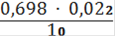
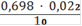 = 0,00154
= 0,00154
См(Fe2+) = 
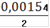 = 0,00077(Fe2+) = 0,00077 ∙ 0,25= 0,0001925(Fe2+) = 0,0001925 ∙ 55,845 = 0,01075(Fe2+)=
= 0,00077(Fe2+) = 0,00077 ∙ 0,25= 0,0001925(Fe2+) = 0,0001925 ∙ 55,845 = 0,01075(Fe2+)= 
 ∙ 100% = 0,75%(Fe2O3) = 0,92%
∙ 100% = 0,75%(Fe2O3) = 0,92%
· Керамика №55 ((2011 г.) Чауская ШР) (коричневато-желтого цвета)
V1 = 0,08 мл
V2 = 0,09 мл
V3 = 0,08 мл
Vср = 0,08 мл
Сн(Fe2+) = 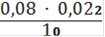
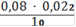 = 0,000176
= 0,000176
См(Fe2+) = 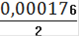
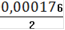 = 0,000088(Fe2+) = 0,000088 ∙ 0,25= 0,000022(Fe2+) = 0,000022 ∙ 55,845 = 0,00123(Fe2+)=
= 0,000088(Fe2+) = 0,000088 ∙ 0,25= 0,000022(Fe2+) = 0,000022 ∙ 55,845 = 0,00123(Fe2+)= 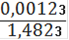
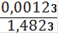 ∙ 100% = 0,08%(Fe2O3) = 0,1%
∙ 100% = 0,08%(Fe2O3) = 0,1%
Заключение
В результате нашей работы был проведен обзор литературы.
Отработана методика определения железа +2.
Определены значения содержания железа в представленных образцах.
Список использованной литературы
1. Алексеев В.Н. Количественный анализ. Под ред. д-ра хим. наук П.К. Агасяна. Издание 4-е, перераб. М., „Химия". 1972. 504 е.; 24 табл.; 76 рис.;
. Васильев В.П. Аналитическая химия. В 2 ч. Ч. 1 Гравиметрический и тиртриметричейкий методы анализа: Учеб. для химико-технол. спец вузов - М.: Высш.шк. 1989. - 302 сл.: ил.;
. Е. Данкевич, О. Жакова. Знакомьтесь, глина. С.-П. Кристалл. 1998.