1. Вычислить константу диссоциации BaO по реакции BaO →Ba + ½ O2 при 4000 К, если известны константы реакций:
BaO → Ba + O•; K1 = 0,0156
O2 → 2O•; K2 = 2,1892
Для решения этой задачи необходимо составить цикл:
BaO →Ba + ½ O2 «X»
– BaO → – Ba – O• – «1»
+½ O2 → + O• +½ «2»
Сумма реакций в цикле: «Х» – «1» +½ «2» = 0
Произведение всех констант в цикле равно 1:
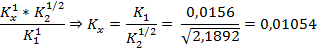
Ответ: 1,054 * 10-2.
2. Зависимость константы химического равновесия от температуры для реакции CO + H2O↑ → H2 + CO2 описывается следующим уравнением:
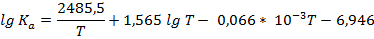
Вывести уравнения ∆Hº; ∆Sº; ∆Gº; ∆cPº = f (T) и вычислить значения этих величин при 400 К.
Переведём десятичный логарифм в натуральный, для этого домножим каждое слагаемое на ln10 ≈ 2,303
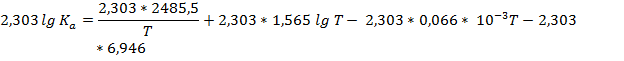
По свойству логарифмов 
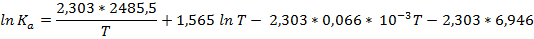
Примечание. На мой взгляд нет необходимости умножать сами числа, проще записывать все выражения в виде изначальных чисел и сомножителей, образовавшихся от перевода логарифма и/или взятия производной. Так вам будут видны все ваши предыдущие операции.
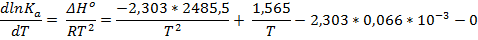
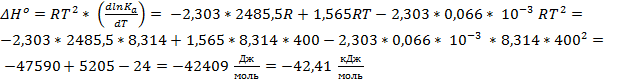
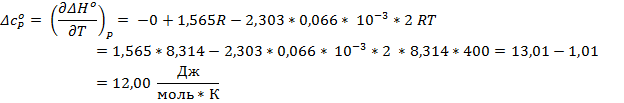
Легко заметить, что 1,565*R – коэффициент Δa, а – 2,303 * 0,066*10-3R – коэффициент Δb
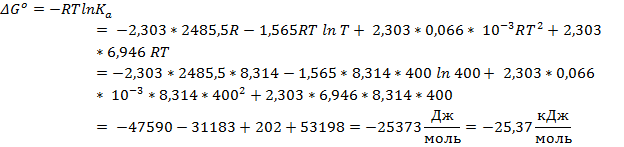
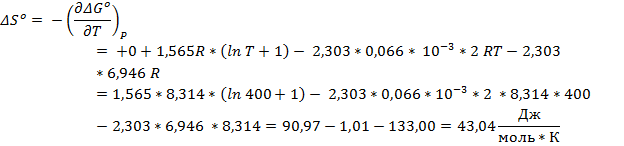
Ответ: ∆Hº = -42,41 кДж/моль; ∆Sº = - 42,55 Дж/(моль * К); ∆Gº = -25,53 кДж/моль; ∆cPº = 12,00 Дж/(моль * К)
3. Зависимость константы химического равновесия от температуры для реакции 2SO2 + O2 → 2SO3
описывается следующим уравнением:
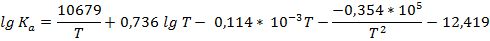
Вывести уравнения ∆Hº; ∆Sº; ∆Gº; ∆cPº = f (T) и вычислить значения этих величин при 1000 К.
Для самостоятельного решения
Ответ: ∆Hº = -194,68 кДж/моль; ∆Sº = - 184,05 Дж/(моль * К); ∆Gº = -10,50 кДж/моль; ∆cPº = 9,13 Дж/(моль * К)
4. Равновесное давление водяного пара по реакции Ca(OH)2 → CaO + H2O равно 100 мм рт. ст. при 450 ºС и 400 мм рт. ст. при 531 ºС. Найдите среднее значение энтальпии в данном интервале температур. Найдите температуру при которой равновесное давление паров воды составит 200 мм рт. ст.
Выразим константу 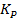 :
:
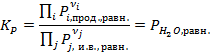
Поскольку в реакции всего 1 газ, то выражение константы получается максимально простым. Студенты часто ошибочно полагают, что меняя давление водяного пара в системе можно повлиять на константу химического равновесия – однако это не так, т.к. здесь используется равновесное давление пара. Т.е. если уменьшить давление пара ниже равновесного, то начнётся реакция разложения гидроксида (прямая реакция), если повысить выше равновесного, то начнётся образование гидроксида (обратная реакция).
Запишем изобару Вант-Гоффа:

и разделим переменные:
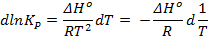
Проинтегрируем в приближении  :
:
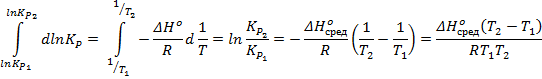
Выразим  :
:
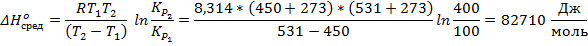
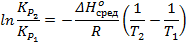
Перепишем это выражение так, чтобы оно содержало данные о третьем состоянии системы:
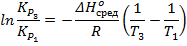
И выразим 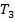 :
:
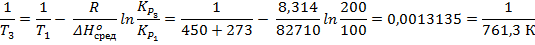
Ответ: 82,71 кДж/моль; 761 К
5. Степень диссоциации PCl5 при 473 К и P = 1 атм равна 0,485, а при 523 К и P = 1 атм – 0,8. Рассчитайте средний тепловой эффект реакции
PCl5↑ → PCl3↑ + Cl2↑ в пределе температур 473 – 523 К. Также определите значение константы равновесия при температуре 500 К.
Для начала необходимо вычислить значения констант при данных температурах. Если начальное количество молей PCl5 составляло n0, то к равновесию осталось (1-α)*n0. Также к равновесию образовалось по α*n0 молей PCl3 и Cl2, где α – степень диссоциации. Тогда:
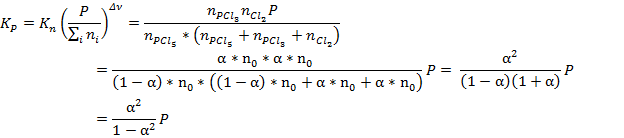
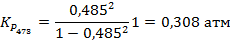
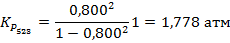
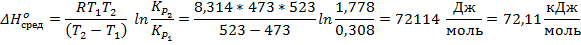
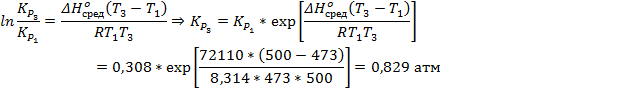
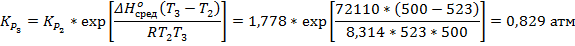
Константа рассчитывается как через первую, так и через вторую точку, за ответ принимается среднее значение.
Ответ: 72,11 кДж/моль; K473 = 0,308 атм; K500 = 0,829 атм; K523 = 1,778 атм.
6. Пользуясь справочными данными о приведённой энергии Гиббса и энтальпии образования веществ при 0 К рассчитать Ка реакции
N2 + O2 → 2NO при 1000 К
Воспользуемся табл. 50 (стр. 102) по данным о приведённой энергии Гиббса:
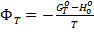 , , 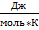
| 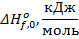
| |
| N2 | 197,93 | |
| O2 | 212,08 | |
| NO | 217,00 | 90,15 |
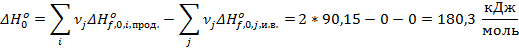
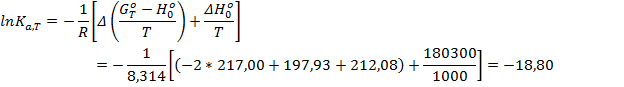
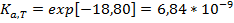
∆Hº0 = 180,3 кДж/моль; ∆(GºT – Hº0)/T = -23,99 Дж/(моль К)
Ответ: Ка =6,84 * 10-9.
7. Определить КР и КС реакции 2H2O↑ → 2H2 + O2, если известны объём системы V, температура Т, степень диссоциации α, исходное число молей n0.
Если исходное количество молей воды n0, то к равновесию останется (1-α)*n0. Также к равновесию образуется α*n0 молей водорода и 1/2 α*n0 молей кислорода.
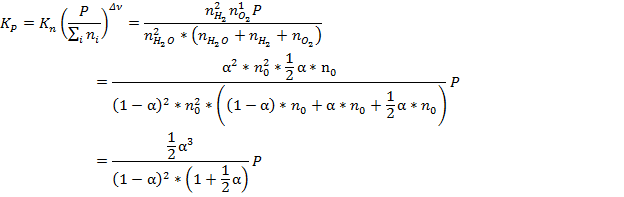
Заменим давление в системе по закону Менделеева-Клапейрона:
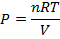
Поскольку речь идёт о равновесном давлении, то n – равновесное количество молей = (1 + ½ α)n0
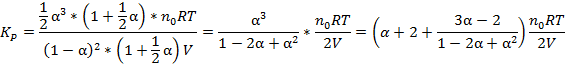
Таким образом мы получили параметрическое уравнение, решение которого позволяет подбирать условия проведения химической реакции.
Ответ: 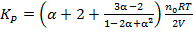
8. Рассчитать равновесный выход продукта (x) в реакции димеризации оксида азота 2NO2 → N2O4, если известны КР и общее давление Р. Исходное количество NO2 1 моль.
Для самостоятельного решения.
Ответ: 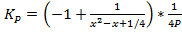
Вопросы для самоконтроля:
1. Влияние температуры на константу химического равновесия.
2. Влияние давления на смещение химического равновесия.
3. Связь константы химического равновесия со стандартным изменением энергии Гиббса.
4. Как учитываются чистые (в т.ч. твёрдые) вещества при определении равновесного состояния?