Введение
Актуальность работы
На сегодняшний день квасцы имеют очень широкое применение [6]. Их используют в промышленности, например, для очистки воды, для дубления кожи, для окрашивания различных тканей и пряжи. Они также используются в огнетушителях, к тому же растворы, содержащие квасцы, могут быть использованы для увеличения устойчивости тканей к огню. Квасцы применяют в фотопромышленности для фотоэмульсий на желатиновой основе. В медицине квасцы применяют как вяжущее, прижигающее и кровоостанавливающее средство ("квасцовый карандаш"). Антибактериальные свойства квасцов позволяют использовать их для производства так называемых дезодорантов-кристаллов. В кулинарии также нашлось применение квасцам: их используют при производстве разрыхлителей для выпечки хлебобулочных изделий.
Квасцы представляют интерес для исследования правильной формы кристаллов, которая является проявлением внутренней симметрии кристаллической решётки. Кристаллы квасцов могут быть различных цветов в зависимости от их состава, соответственно, предметом исследования может стать влияние состава квасцов на цвет кристалла.
Цель работы
Получить и вырастить кристалл экзотических квасцов (например, с катионами М+ = NH4+, Na+; M3+ = Fe3+, Y3+, La3+ и др.).
Задачи
1. Получить квасцы.
2. Оптимизировать методику получения квасцов применительно к конкретным квасцам.
3. Вырастить кристалл квасцов.
4. Изучить строение и свойства кристалла.
Литературный обзор
Структура и состав квасцов
Квасцы — двойные соли, кристаллогидраты сульфатов трёх- и одновалентных металлов.
Вследствие слабо выраженного основного характера трехвалентных катионов квасцы обладают кислой реакцией и кислым вкусом (kwas — по-польски — кислота).
Квасцы отвечают структурному типу M+M3+(SO4)22- · 12H2O и производятся от трёхвалентных катионов, радиусы которых лежат в пределах 0,57 Å (Al3+) — 0,92 Å (In3+). Сюда относятся Al3+, Ga3+, In3+, Ti3+, V3+, Cr3+, Mn3+, Fe3+, Co3+, Rh3+, Ir3+ (Таблица 1).
Таблица 1. Ионные радиусы М3+ [1]
| Al3+ | Ga3+ | In3+ | Ti3+ | V3+ | Cr3+ | Mn3+ | Fe3+ | Co3+ | Rh3+ | Ir3+ |
| 0,57 | 0,62 | 0,92 | 0,69 | 0,67 | 0,64 | 0,7 | 0.67 | 0,64 | 0,75 | 0,65 |
В качестве одновалентных катионов в состав квасцов могут входить Na+, K+, Rb+, Cs+, Tl+, NH4+ (Таблица 2).
Таблица 2. Ионные радиусы М+ [1]
| Na+ | K+ | Rb+ | Cs+ | Tl+ | NH4+ |
| 0,98 | 1,33 | 1,49 | 1,65 | 1,36 | 1,43 |
В периодической системе образующие квасцы элементы располагаются довольно закономерно:
1. Внутри одного вертикального ряда периодической системы радиусы ионов с одинаковым зарядом увеличиваются с возрастанием атомного номера, поскольку растёт число электронных оболочек, а значит, и размер атома.
2. Для одного и того же элемента ионный радиус возрастает с увеличением отрицательного заряда и уменьшается с увеличением положительного заряда.
3. У элементов одного периода атомные и ионные радиусы уменьшаются. А поскольку в периодах 6 и 7 по 32 элемента, так как в них входят лантаноиды и актиноиды соответственно, то следующие за лантаноидами и актиноидами s- и p-элементы могут иногда иметь даже меньшие радиусы, чем предыдущий элемент в вертикальном ряду, например Zr (1,6 Å) и Hf (1,59 Å).
Под эффективным радиусом иона понимается радиус сферы его действия, причём ион считается несжимаемым шаром. Эффективный радиус иона зависит от атомного номера элемента и заряда иона. От радиусов ионов зависит устойчивость кристаллической решётки квасцов.
Наибольшей устойчивостью обычно отличаются цезиевые квасцы, наименьшей — натриевые. Последние для большинства перечисленных выше солеобразователей вообще не могут быть получены, они образуются лишь с Al3+ (Na+Al3+(SO4)2·12H2O). Иногда наименьшей устойчивостью, по-видимому, обладают производные Tl+, K+ и NH4+. Например, квасцы Ti3+ известны только для Rb+ и Cs+ [1].
Растворимость квасцов при обычных условиях в большинстве случаев сравнительно невелика. Поэтому они могут быть легко получены из отдельных составляющих солей. По ряду Na+—Cs+ растворимость квасцов быстро уменьшается, так как устойчивость квасцов возрастает, а влияние химической природы М3+ сказывается на растворимости квасцов сравнительно слабо, как это показывают приводимые ниже в качестве примеров данные (Таблица 3).
Таблица 3. Растворимость некоторых квасцов в моль/л H2O при 25°С [3]
| Na+ | K+ | Rb+ | Cs+ | NH4+ | Tl+ | |
| М+Al3+(SO4)2·12H2O | 1,78 | 0,28 | 0,053 | 0,014 | 0,39 | 0,18 |
| Al3+ | Ga3+ | In3+ | V3+ | Cr3+ | Fe3+ | |
| Cs+М3+(SO4)2·12H2O | 0,014 | 0,043 | 0,17 | 0,021 | 0,015 | 0,045 |
При повышении температуры растворимость квасцов очень сильно увеличивается (Рис. 1).
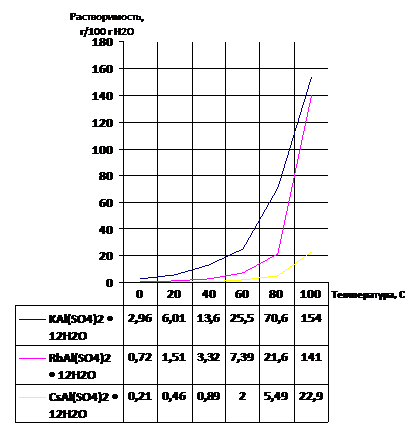
Рис. 1. Зависимость растворимости квасцов калия, рубидия и цезия от температуры [8]
Зависимость устойчивости квасцов от радиусов М3+ и М+ можно хорошо проследить на сульфатах Ga3+ (0,62 Å), In3+ (0,92 Å) и Tl3+ (1,05 Å). Для первого из этих элементов квасцы могут быть получены по всему ряду одновалентных катионов: K+ (1,33 Å), NH4+ (1,43 Å), Rb+ (1,49 Å), Cs+ (1,65 Å). Напротив, Tl3+ квасцов вообще не образует и для него известны лишь кристаллогидраты состава М+Tl3+(SO4)2·4H2O. У занимающего промежуточное положение In3+ квасцы являются устойчивой формой лишь для Cs+. В качестве метастабильной фазы они могут быть получены для Rb+ и NH4+, а с K+ не образуются [1].
Таким образом, устойчивость квасцов при однотипной структуре внешней электронной оболочки М3+ возрастает по мере уменьшения (конечно, лишь до известного передела) его радиуса и увеличения радиуса М+.
Повышение температуры благоприятствует возникновению более бедных водой кристаллогидратов. Напротив, при пониженных температурах удаётся выделить даже такие неустойчивые, из-за маленького радиуса иона Li+ (0,68 Å), квасцы, как литиево-алюминиевые квасцы [1].
Расположение частиц (атомов, ионов, молекул) становится упорядоченным, когда вещество переходит из аморфной фазы (газ, жидкость) в кристаллическую, соответствующую минимуму свободной энергии при данных условиях. Частицы в кристаллах образуют правильные, упорядоченные, симметричные решётки. Элементарная ячейка — это симметричная фигура, вершинами которой являются наиболее близко расположенные частицы вещества, и при её многократном повторении образуется решётка, заполняющая всё пространство без промежутков. Кристаллы, у которых одинакова симметрия элементарных ячеек объединяют в группы (сингонии). Квасцы относятся к кубической сингонии, в которой элементарной ячейкой является куб [2]. Класс симметрии квасцов обозначается m3m. Симметрия внешней формы кристалла отражает его пространственную структуру. Монокристаллы квасцов обычно принимают форму правильного октаэдра, который отвечает всем элементам симметрии кубической сингонии.
Известны также селенатные квасцы состава M+M3+(SeO4)22-·12H2O, в которых сульфат-ион заменён ионом селената.
Наиболее известные квасцы:
· Алюмоаммонийные квасцы — AlNH4(SO4)2 · 12H2O.
· Алюмокалиевые квасцы — KAl(SO4)2 · 12H2O.
· Алюмонатриевые квасцы — NaAl(SO4)2 · 12H2O.
· Алюморубидиевые квасцы — RbAl(SO4)2 · 12H2O.
· Алюмоцезиевые квасцы — CsAl(SO4)2 · 12H2O.
· Железоаммонийные квасцы — NH4Fe(SO4)2 · 12H2О
· Железокалиевые квасцы — KFe(SO4)2 · 12H2O
· Хромокалиевые квасцы — KCr(SO4)2 · 12H2O.