В состав нитрофоски входят: нитратный азот [ 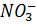 ] в виде нитратов аммония и калия, аммонийный азот [
] в виде нитратов аммония и калия, аммонийный азот [ 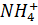 ] в виде нитрата аммония и дигидрофосфата аммония. Количество и качество нитрофоски, как и всех азотно-фосфорно-калийных удобрений, устанавливают по содержанию общего, аммонийного и нитратного азота.
] в виде нитрата аммония и дигидрофосфата аммония. Количество и качество нитрофоски, как и всех азотно-фосфорно-калийных удобрений, устанавливают по содержанию общего, аммонийного и нитратного азота.
Методика оксидиметрического определения нитратного азота, позволяет выполнить анализ в течение 10–15 минут. Сущность метода заключается в восстановлении азотной кислоты до оксида азота (II) сульфатом железа (II) и оттитровывании избытка FeSO4 растворами перманганата или бихромата калия по уравнениям реакций:
2HNO3 + 6FeSO4 + 3H2SO4 = 2NO + 3Fe2(SO4)3 + 4H2O 9
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O 10
6FeSO4 + K2Cr2O7 + 7H2SO4 = 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O 11
В работе титрование осуществляется раствором перманганата калия. Титрованию перманганатом не мешают различные ионы, содержащиеся в продукте, за исключением хлоридов и карбонатов. Влияние хлоридов при титровании перманганатом устраняется медленным титрованием сильно разбавленных растворов. Карбонаты отделяют фильтрованием после обработки навески нитрофоски водой. При необходимости выполнения анализа на фосфаты азотнокислотной вытяжки или пульпы жидкую фазу отделяют от твердой фильтрованием. В соответствии с этим применяют один и тот же ход анализа вытяжки, пульпы или готового продукта.
Посуда, материалы и реактивы
· мерные колбы на 500 и 1000 мл; конические колбы на 250 и 500 мл; мерные цилиндры на 10, 25, 50, 100 и 250 мл; пипетка на 5 мл; фильтры.
· Реактивы: раствор KMnO4 (0,1 н.); раствор FeSO4 (1 М); смесь Циммермана – Рейнгардта.
Выполнение работы
На аналитических весах взвешивают ~ 2 г нитрофоски и помещают в коническую колбу на 250 мл. В колбу добавляют 100 мл воды, после чего закрывают её пробкой и энергично встряхивают в течение нескольких минут.
После этого отфильтровывают осадок, собирая фильтрат в мерную колбу на 500 мл. Осадок промывают на фильтре водой в два приёма до 50 мл. Промывные воды также собирают в колбу с фильтратом. Затем водой доводят объём раствора до метки и перемешивают. Получают 500 мл анализируемого раствора.
Пипеткой отбирают 5 мл анализируемого раствора и переносят в коническую колбу на 250 мл, туда же добавляют пипеткой на 5 мл 1 М раствора FeSO4 и при перемешивании доливают из мерного цилиндра 4 мл концентрированной серной кислоты. Содержимое колбы нагревают до кипения и кипятят 3 мин. Горячий раствор тонкой струйкой выливают в коническую колбу на 500 мл, куда предварительно наливают 100 мл холодной дистиллированной воды и перемешивают. Колбу, в которой нагревали раствор, ополаскивают 2 раза небольшим количеством воды, добавляя её к основному раствору. После этого цилиндром приливают 4 мл смеси Циммермана-Рейнгардта (для устранения влияния хлоридов при титровании) и титруют 0,1н раствором KMnO4 до бледно-розового окрашивания раствора, сохраняющегося в течение 30 секунд.
Одновременно титруют раствор сульфата железа (холостую пробу). Для этого отбирают пробу раствора сульфата железа точно в таком же количестве и подготавливают для титрования точно так же, как и анализируемую пробу. В этом случае вместо 5 мл анализируемой пробы берут 5 мл воды, добавляют к ним 5 мл 1 М раствора FeSO4, доливают из мерного цилиндра 4 мл концентрированной серной кислоты и не вводят смесь Циммермана-Рейнгардта. Раствор кипятят 2 мин, после чего разбавляют холодной дистиллированной водой и титруют 0,1 н. раствором KMnO4 до бледно-розового окрашивая расвора, сохраняющегося в течение 30 секунд.
Обработка результатов
Содержание нитратного азота 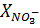 в (%) вычисляют по формуле:
в (%) вычисляют по формуле:
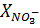 =
= 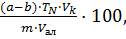 (11)
(11)
где а – количество 0,1н раствора KMnO4, пошедшее на титрование холостой пробы, см3;
b – количество 0,1н раствора KMnO4, пошедшее на титрование анализируемой пробы, см3;
m – масса нитрофоски, г;
TN – титр азота по 0,1н раствору KMnO4, г/см3, TN = 0,000467 г/см3;
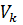 – объём мерной колбы, см3,
– объём мерной колбы, см3, 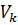 = 500 см3;
= 500 см3;
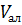 – объем аликвоты раствора нитрофоски, см3;
– объем аликвоты раствора нитрофоски, см3; 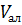 = 5 см3.
= 5 см3.
2.2.2. Определение фосфатов фотоколориметрическим методом
Для выполнения этого определения предварительно готовят растворы, которые используют в дальнейшем для приготовления серии калибровочных растворов и построения калибровочного графика. Эти виды работы для полного понимания методики определения описаны ниже, но в план лабораторной работы студентов не входят. Студенты проводят только подготовку пробы исследуемого раствора нитрофоски и его фотоколориметрирование.
Приборы, оборудование и материалы
· Фотоколориметр любого типа, обеспечивающий измерение оптической плотности при длине волны (430 – 460) нм с абсолютной погрешностью измерений коэффициенты пропускания не более ± 1,0 %;
· Весы лабораторные по ГОСТ Р 53228 специального класса (I) точности, предел допускаемой погрешности взвешивания не более ± 0, 00075 г;
· Весы лабораторные по ГОСТ Р 53228 высокого класса точности, предел допускаемой погрешности не более ± 50 мг;
· Секундомер любого типа по ГОСТ 5072, диапазон измерений от 0 до 60 минут, погрешность измерений ± 0,6 с;
· Кюветы с длиной поглощающего слоя 10 мм;
· Пипетки по ГОСТ 29227: 1(2) – 1, 5, 10, 25;
· Колбы мерные наливные по ГОСТ 1770: 1(2) –100, 250, 1000;
· Стаканы 1(2) – 50, 250 ТХС по ГОСТ 25336.
· Цилиндры мерные 1(2) – 50, 100, 250 по ГОСТ 1770.
· Воронки для фильтрования ВФ 2(3) – 75, 100 ХС по ГОСТ 25336.
· Бумага фильтровальная по ГОСТ 12026.
Реактивы
· Соляная кислота по ГОСТ 3118, плотностью 1,19 г/см3;
· Азотная кислота по ГОСТ 4461, плотностью 1,4 г/см3, раствор с объемным отношением с водой 1:2;
· Вода дистиллированная по ГОСТ 6709;
· Калий фосфорнокислый однозамещенный по ГОСТ 4198;
· Аммоний молибденово-кислый по ГОСТ 3765;
· Аммоний мета ванадиево-кислый по ГОСТ 9336.
Подготовка к выполнению измерений
1) Приготовление раствора мета ванадиево-кислого аммония с массовой концентрацией 0,25 %. Взвешивают 2,5 г NH4VO3 с точностью до 0,01 г, растворяют в 500 см3 горячей воды с температурой 60–90 °С, добавляют 20 см3 азотной кислоты, плотностью 1,4 г/см3, охлаждают, переносят в мерную колбу вместимостью 1000 см3, доливают до метки водой и, если необходимо, фильтруют.
2) Приготовление раствора молибденово-кислого аммония с массовой концентрацией 5 %. Взвешивают 50 г (NH4)6Mo7O24∙4H2O с точностью до 0,01 г, растворяют в 500 см3 воды при температуре 60–70 °С, переносят в мерную колбу вместимостью 1000 см3, охлаждают и доводят водой до метки, если раствор мутный, его фильтруют.
3) Приготовление реактива на фосфаты. Смешивают равные объемы растворов: мета ванадиево-кислого аммония, раствора молибденово-кислого аммония с массовой концентрацией 5% и азотной кислоты, разбавленной 1:2 в указанной последовательности и фильтруют. Раствор хранят в бутыли из темного стекла в холодном месте (допускается при комнатной температуре).
4) Приготовление аттестованной смеси с массовой концентрацией фосфатов в пересчете на P2O5 1,000 ± 0,005 г/дм3. На аналитических весах взвешивают 1,9175 г однозамещенного фосфорнокислого калия KH2PO4, помещают в стакан, растворяют в небольшом количестве воды и количественно переносят в мерную колбу вместимостью 1000 см3, затем доводят до метки водой и перемешивают. Переливают в посуду из полиэтилена.
Построение градуировочного графика
1) Приготовление градуировочных растворов. В ряд мерных колб вместимостью 100 см3 вносят последовательно пипетками 1,0 (контрольная проба); 2,0; 2,5; 3,0; 3,5; 4,0; 4,5; 5,0; 5,5 см3 раствора с массовой концентрацией в пересчете на P2O5 – 1,000 г/дм3. Приливают воду до объёма около 30 см3, по 25 см3 реактива на фосфаты. Доводят объёмы растворов до метки водой, перемешивают.
2) Колориметрирование градуировочных растворов проводят через 15 минут на фотоэлектроколориметре при длине волны λ = 440 нм, с синим светофильтром, в кюветах с длиной рабочей грани 10 мм. Раствор сравнения – раствор, содержащий 1 мг P2O5 в 100 см3 раствора – контрольная проба. Значения оптических плотностей записывают с точностью до третьего десятичного знака.
3) Градуировочный график строят методом наименьших квадратов в координатах оптическая плотность – масса фосфат ионов в пересчете на P2O5 (мг), не менее чем по 6 сериям растворов. Значение градуировочной характеристики необходимо проверять ежемесячно по 3 – 4 определениям, а также при замене прибора. В случае несовпадения величины градуировочной характеристики с прежними значениями больше, чем на 4 % ее необходимо устанавливать вновь, не менее чем по 6 сериям растворов.
Выполнение измерений
Навеску пробы массой 1,5 г (результат взвешивания в граммах записывают с точностью до четвертого десятичного знака), помещают в мерную колбу вместимостью 250 см3, приливают 5 см3 концентрированной азотной кислоты, 150 см3 воды, перемешивают в течение 5–10 минут.
Затем доводят объем раствора до метки водой, перемешивают и фильтруют через фильтр «синяя лента», отбрасывая первые порции фильтрата объемом (30–50) см3.
В мерную колбу вместимостью 100 см3 помещают (1–5) см3 раствора пробы, воды до объема 30 см3 и 2 см3 концентрированной соляной кислоты, нагревают до кипения и кипятят 5 минут. Охлаждают раствор и приливают 25 см3 реактива на фосфаты, доливают водой до метки, перемешивают и через 15 минут фотоколориметрируют раствор относительно раствора, содержащего 1 мг оксида фосфора (V) в 100 см3 раствора.
Обработка результатов
Содержание Р2О5 (в %) вычисляют по формуле:
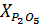 =
= 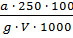 (12)
(12)
где a – количество Р2О5, найденное по калибровочному графику, мг; g – навеска анализируемого вещества, г; V – объем раствора, взятого для анализа, мл.
ТЕХНИКА БЕЗОПАСНОСТИ
Студенты допускаются к работе только после прохождения инструктажа по технике безопасности, изучения инструкций и росписи в журнале.
В целях безопасности ведения лабораторной работы следует выполнять следующие правила:
ü Выполнять работу строго по методическим указаниям.
ü Работать в халате, в случае необходимости использовать индивидуальные средства защиты.
ü Не разрешается оставлять включённую установку без наблюдения.
ü Строго соблюдать правила работы со стеклянной посудой, реактивами и электроприборами, изложенные в общей инструкции по технике безопасности в химической лаборатории.
ü Работать с концентрированными кислотами и раствором аммиака в вытяжном шкафу.
ü Сливать отработанные растворы в специально предназначенные для этих целей ёмкости.
ü Знать правила оказания первой помощи при работе со стеклом, концентрированными кислотами и щелочами.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Основные свойства и применение нитрофоски.
2. В виде каких соединений содержится P, N и K в нитрофоске?
3. В чем преимущества применения нитрофоски по сравнению с другими простыми и сложными удобрениями?
4. Как получают сложные удобрения?
5. Какие вы знаете виды сложных удобрений?
6. В чем сущность разложения природных фосфатов?
7. Преимущества азотнокислотного разложения фосфатов?
8. Какой состав пульпы, после нейтрализации вытяжки аммиаком?
9. Что такое ретур?
10. Какими способами получают нитрофоску?
11. Каково соотношение питательных элементов в нитрофоске?
12. Чем отличается между собой фосфатная, сульфатная и карбонатная нитрофоска?
13. По какому из способов переработки азотнокислотной вытяжки наименьшие капитальные затраты и себестоимость?
14. На содержание каких питательных веществ анализируется готовый продукт – нитрофоска?
15. Как определяется влага в нитрофоске?
16. В чем сущность оксидиметрического определения нитратного азота?
17. Как устраняется влияние хлоридов и карбонатов при определении азота перманганатным способом?
18. В чем сущность фотоколориметрического определения фосфатов?
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Технология фосфорных и комплексных удобрений / Под ред. С.Д. Эвенчика, А.А. Бродского. – М.: Химия, 1987. – 464 с.
2. Кувшинников, И.М. Минеральные удобрения и соли / И.М. Кувшинников. – М.: Химия, 1987. – 256 с.
3. Позин, М.Е. Технология минеральных удобрений / М.Е. Позин. – М.: Химия, 1989. – 352 с.
4. Руководство к практическим занятиям по технологии неорганических веществ / Под ред. М.Е. Позина. – Л.: Химия, 1980. – 380 с.
5. Основы аналитической химии / Под ред. Ю.А.Золотова. – М.: Высш. шк., 2004. – 412 с.
6. Кельман, Ф.Н. Методы анализа при контроле производства серной кислоты и фосфорных удобрений / Ф.Н. Кельман, Е.Б. Бруцкус, Р.Х. Ошерович. – М.: Химия, 1985. – 392 с.