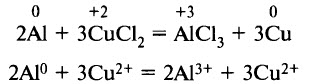ТЕМА: Алюминий
Ключевые слова конспекта: алюминий, свойства алюминия, получение и применение алюминия, алюмосиликаты, глина, оксид алюминия, боксит, дюралюмин, дюраль.
Алюминий Al – элемент № 13, 3–го периода, IIIA группы, Ar (Al) = 27. Электронная конфигурация невозбуждённого атома алюминия 1s22s22p6 3s23p1:
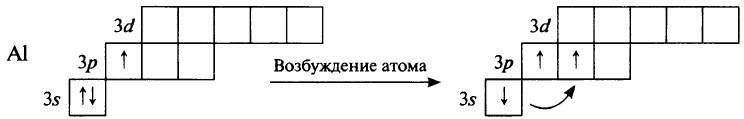
Алюминий является р -элементом. В своих соединениях он всегда имеет степень окисления +3. Оксид и гидроксид алюминия (Al2O3 и Al(ОН)3 соответственно) амфотерны. Существует водородное соединение алюминия – гидрид алюминия AlH3 (алан) – белый порошок.
По распространённости в земной коре алюминий занимает 4-е место (после О, Si, Н). Основная масса алюминия сосредоточена в алюмосиликатах. Продуктом разрушения алюмосиликатов является глина, она состоит из каолинита – Al2O3 • 2SiO2 • 2H2O. Обычно глина содержит примесь соединений железа, придающую ей бурый цвет. Из других минералов наибольшее распространение имеет боксит – Al2O3 • n H2O
АЛЮМИНИЙ – ПРОСТОЕ ВЕЩЕСТВО
Алюминий – серебристо-белый металл (на воздухе покрывается плотной тонкой плёнкой оксида), плотность 2,7 г/см3 (лёгкий металл), легкоплавкий (t °пл. = 660 °С).
На воздухе алюминий покрывается прочной тончайшей (10–8 м) защитной плёнкой оксида, которая препятствует проникновению кислорода к металлу и практически полностью прекращает дальнейшее окисление.
Алюминиевый порошок сгорает при нагревании в кислороде: 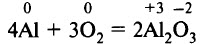
При окислении алюминия выделяется большое количество теплоты. Нагретый порошок алюминия при попадании в атмосферу кислорода реагирует с выделением огромного количества теплоты, достигается температура до 3000–3500 °С. Тепловой эффект реакции алюминия с кислородом чрезвычайно высок, образование этого соединения энергетически очень выгодно.
При нагревании алюминий легко реагирует с серой: 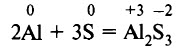
Алюминиевый порошок легко реагирует с галогенами и сгорает в атмосфере хлора. Кусочек алюминия, с которого снята оксидная плёнка, бурно реагирует с бромом. Эти реакции идут без нагревания: 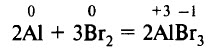
Алюминиевый порошок реагирует с кристаллическим йодом, в присутствии катализатора (или при нагревании) выделяются капельки воды.
Алюминий без оксидной плёнки реагирует с азотом при сильном нагревании (800–1200 °С), образуя нитрид алюминия: 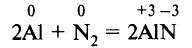
При сильном нагревании (1500–1700 °С) алюминий реагирует с углеродом (графитом) с образованием карбида алюминия: 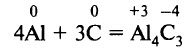
Алюминий непосредственно не реагирует с водородом. Гидрид алюминия получают косвенным путём.
Алюминий энергично взаимодействует с водой, если механическим путём или амальгамированием снять предохраняющее действие оксидной плёнки: 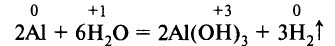
Вследствие высокого теплового эффекта соединения алюминия с кислородом алюминий активно восстанавливает многие металлы из оксидов (алюмотермия): 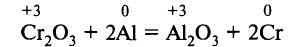
При этом реакция обычно сопровождается выделением большого количества тепла и повышением температуры до 1200–3000 °С. Алюмотермия применяется в производстве марганца, хрома, ванадия, вольфрама, ферросплавов.
Как метод получения металлов, алюмотермия была предложена Н. Бекетовым в 1859 г. Её используют для получения многих металлов (Мп, Cr, V, W, Sr, Ва и др.).
Алюминий реагирует с галогеноводородными кислотами, разбавленной серной и азотной кислотами с образованием солей, в которых алюминий находится в катионной форме, и выделением водорода. Например: 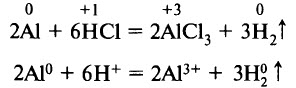
Алюминий не реагирует с азотной и серной концентрированными кислотами в обычных условиях. На поверхности алюминия образуется защитная оксидная плёнка, алюминий пассивируется. Алюминий реагирует с разбавленной азотной кислотой (2–3 моль/л) с образованием нитрата алюминия, нитрата аммония и воды: 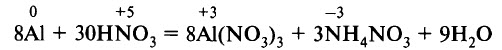
Алюминий активно взаимодействует с растворами щелочей. Щёлочи растворяют оксидную плёнку на поверхности алюминия. Образуются соли, в которых алюминий находится в анионной форме, и выделяется водород: 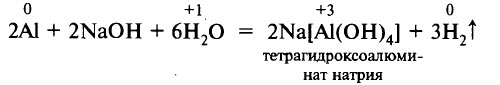
Алюминий реагирует с растворами солей, восстанавливая катионы менее активных металлов (металлов, расположенных в ряду напряжений правее алюминия):