План коллоквиума
1) Основные понятия химической термодинамики: система (изолированная и неизолированная, гомогенная и гетерогенная), фаза (простая и смешанная); компонент; параметры системы; функция состояния; термодинамический процесс.
2) Первое начало термодинамики (формулировка, математическое выражение, знаки входящих величин).
3) Закон Гесса (формулировка, математическое выражение, условия применимости, следствия).
4) Взаимосвязь QP и QV.
5) Зависимость теплового эффекта от температуры.
6) Расчетное уравнение для экспериментального определения теплоты растворения вещества.
7) Калориметрическая установка, постоянная калориметра.
8) Порядок работы.
Теоретические основы работы и описание установки
Цель работы: ознакомление с термохимическими измерениями, экспериментальное определение теплоты растворения соли.
Любая химическая реакция и любое физико-химическое превращение сопровождается выделением или поглощением тепла (тепловым эффектом). Величину теплового эффекта измеряют с помощью специального прибора – калориметра (рисунок 1).

Рисунок 1 – Калориметр для определения теплового эффекта растворения
Калориметр состоит из сосуда 1, в который помещается исследуемое вещество, и защитной оболочки 2, уменьшающей тепловое взаимодействие сосуда и исследуемого вещества с окружающей средой. Для определения тепловых эффектов при температуре от –20 до + 50° применяют калориметр с воздушной изотермической оболочкой. В крышке калориметра 3 имеются отверстия, в которые вставляют стеклянную мешалку 4 и термометр Бекмана 5, позволяющий измерить изменения температуры (но не температуру) с точностью до 0,002° С.
При проведении в калориметре какого-либо процесса, сопровождающегося тепловым эффектом, в теплообмене участвуют не только сосуд с исследуемым веществом, но и остальные части калориметрической системы (мешалка, термометр Бекмана, крышка и др.), поэтому уравнение теплового баланса имеет вид:
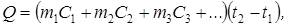 (1)
(1)
где Q – теплота процесса (например, процесса растворения соли);
m 1 – масса раствора;
C 1 – теплоёмкость раствора;
m 2 – масса сосуда;
С 2 – теплоёмкость сосуда;
m 3 – масса мешалки;
C 3 – теплоёмкость мешалки, и т.д.;
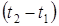 – изменение температуры.
– изменение температуры.
Так как все измерения проводятся в одном и том же калориметре, величины m 2, m 3 и т.д., а также С 2, C 3 и т.д. остаются постоянными во всех опытах. Обозначим выражение
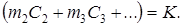 (2)
(2)
K называют теплоёмкостью калориметрической системы или постоянной калориметра. Величина K указывает количество тепла, которое необходимо сообщить участвующим в теплообмене частям калориметра, чтобы повысить их температуру на один градус.
Для определения K проводится дополнительный опыт, в котором измеряют изменение температуры при растворении какой-либо соли (обычно KCl), тепловой эффект растворения которой известен. Для дополнительного опыта уравнение (1) запишется так:
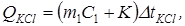 (3)
(3)
где QKCl – теплота растворения KCl (252,7 Дж/г при18° С);
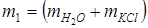 – масса раствора KCl;
– масса раствора KCl;
C 1 – теплоёмкость раствора (С 1 = 4,1 Дж/г·град);
K – постоянная калориметра;
DtKCl – изменение температуры в процессе растворения KCl.
Из уравнения (3) находим K:
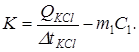 (4)
(4)
Теплоту растворения исследуемой соли Qx рассчитываем по уравнению: