Как указывалось выше, гелеобразные выделения невозможно получить в неизмененном состоянии и достаточном для исследования количестве; они трудно отделимы от копчиков корней и их не всегда можно обнаружить обычным способом. Кроме того, как отмечает ряд исследователей, в гелеобразных мешках всегда находится огромноеколичество отдельных растительныхклеток.
Чтобы удостовериться в возможности активного воздействия гелеобразных выделений на окружающую среду, мы исследовали у ряда растений жизнеспособность корневых чехликов и содержащихсяв них отдельных клеток. Приводим некоторые данные.
Для различия отчленившихся живых и мертвых клеток корней применяется ряд методов. Из них мы использовали два: плазмолитический и флуоресцентно-микроскопический. Наиболее достоверные данные можно получить с помощью первого, но лишь в том случае, если исследуются эпидермальные (покровные однослойные) ткани. В основе еголежит представление, согласно которому явление плазмолиза свойственно только живым клеткам. Одно из его преимуществ заключается в возможности с достаточной точностью определять величину осмотического давления внутри живых клеток. Флуоресцентно-микроскопический метод основан на различной по цвету флуоресценции живых и мёртвых клеток при окраске флуорохромами.
Объектами исследований служили 6—12 -дневные проростки кукурузы, гороха и других видов растений, выращенные в водной культуре и во влажных воздушной и почвенной камерах. Исследовали цельные неопробковевшие кончики корней, поперечные и продольные их срезы и отдельные клетки. В качестве плазмолитика использовали растворы сахарозы в концентрации от 0,1 до 0,8 М. Для лучшей видимости клеток и их содержимого к препаратам добавляли небольшое количество метиленовой сини или генцианвиолета. Флуорохромировали препараты акридином оранжевым в концентрации от 1: 5000 до 1: 100 000. Исследования проводили при помощи люминесцентного микроскопа МЛ- 2 в синем свете.
Известно, что осмотическое давление в листьях, стеблях, черешках и клубнях полевых растений сравнительно невелико (около 8 - 12 атм) и лишь у корней сахарной свеклы оно больше (табл. 3).
Таблица 3 Осмотическое давление в клетках разных растений*
| Растение и его органы | Величина атмосферного давления, атм |
| Корень моркови | 11-12 |
| Подсемядольное колено редиса | 8,6-8,8 |
| Корень сахарной свёклы | 12-18 |
| Хвоя | 18,8-38,8 |
| Ячмень | 9-10 |
| Клубни картофеля | 10,6 |
| Черешки листьев картофеля | 8,9 |
| Листья, черешки, стебли гороха | 9,5-10,3 |
| Листья пшеницы | 9,4 |
| Наземные растения | 5-10 |
| Подводные растения (в пресной воде) | 1-3 |
| Растения на засоленной почве в засушливой зоне | 60-100 |
| Ягоды винограда, корни свёклы | 20-40 |
| *По Д.Д. Вердеревскому и Д.А. Сабинину. |
Что же касается его величины в неопробковевшей части корней и методов его определения, никаких данных влитературе мы не обнаружили.
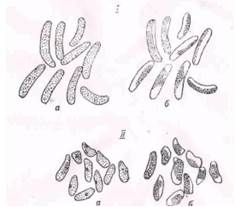
Просмотр большого числа препаратов показал, что в 0,1 М растворе сахарозы в отчлененных клетках кукурузы, гороха и пшеницы плазмолиз не происходит. У кукурузы и гороха он не обнаружен и при 0,2 М концентрации и только у пшеницы наблюдался у 17% клеток. При концентрации раствора сахарозы 0,3 М плазмолиз установлен приблизительно у половины клеток всех растений. С увеличением её число плазмолизированных клеток возрастает, и при концентрации раствора 0,6 М плазмолиз выявлялся уже во всех клетках без исключения (табл. 4 ). При этом форма его у разных растений неодинакова (рис. 3).
Принимая, что концентрация содержимого клеток изотонична 0,35 М раствору сахарозы, можно считать осмотическое давление в них равным 9,58 атм, т.е. почти таким же, какое наблюдалось рядом исследователей в клетках надземных и некоторых подземных органов растений, растущих в нормальных почвенных условиях.
При использовании флуоресцентного метода для распознавания живых и мёртвых клеток чётких ре-зультатов мы не получили. Применение рекомендуемых Штругером концентраций (1:5000 и 1:10 000) акридина оранжевого вызывало через 5—10 минут красное свечение всех клеток корней, в том числе и заведомо живых корневых волосков. Акридин оранжевый меньшей концентрации (1:50 000 и 1:100 000), использовавшийся некоторыми исследователями для распознавания живых и мертвых клубеньковых бактерий, также не дал эффекта. Все клетки непосредственно на поверхности кончиков корней и в глубине гелеобразного чехла светились зеленым цветом.
Таким образом, лучшим методом идентификации живых и мертвых клеток иустановления величины осмотического давления корней следует признать плазмолиз отчлененных клеток, который мы и рекомендуем для широкого применения.
 Одним изважнейших свойств гелеобразных выделений корней растений, как установлено нами, является их большая устойчивость к растворителям. В воде при температуре ниже 50°С они практически не раствори-мы. Они растворяются иотделяются от кончиков корней при 70°С в течение 10 минут при 95°С и выше в течение 1 минуты. В этиловом спирте, ацетоне и смеси спирта с эфиром, как и при незначительном подсушивании на воздухе, гелеобразные чехлы сильно уменьшаются в объеме, их содержимое плотно пристает к поверхности корня и не просматривается под микроскопом. Однако если подсохший корешок поместить в воду, то через несколько минут гелеобразное вещество вновь набухает, чехол восстанавливается до первоначальногоразмера и после окраски генцианвиолетом или другими анилиновыми красителями вновь хорошо виден под микроскопом. Это подтверждает, что корнеоблекающее гелеобразное вещество представляет собой высокомолекулярный гидрофильный коллоид.
Одним изважнейших свойств гелеобразных выделений корней растений, как установлено нами, является их большая устойчивость к растворителям. В воде при температуре ниже 50°С они практически не раствори-мы. Они растворяются иотделяются от кончиков корней при 70°С в течение 10 минут при 95°С и выше в течение 1 минуты. В этиловом спирте, ацетоне и смеси спирта с эфиром, как и при незначительном подсушивании на воздухе, гелеобразные чехлы сильно уменьшаются в объеме, их содержимое плотно пристает к поверхности корня и не просматривается под микроскопом. Однако если подсохший корешок поместить в воду, то через несколько минут гелеобразное вещество вновь набухает, чехол восстанавливается до первоначальногоразмера и после окраски генцианвиолетом или другими анилиновыми красителями вновь хорошо виден под микроскопом. Это подтверждает, что корнеоблекающее гелеобразное вещество представляет собой высокомолекулярный гидрофильный коллоид.
Рис. 3 Меристемные клетки, отчленяемые кончиками корней горо-ха (I) и кукурузы (II): а - неплазмолизированные, б - плазмолизи-рованные
Таблица 4 Зависимость плазмолиза у отчленённых корневыми чехликами клеток от концентрации раствора сахарозы, % общего числа просмотренных клеток.
| Растение | Концентрация сахарозы, М | ||||||
| 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | |
| Кукуруза | отсутствует | отсутствует | |||||
| Горох | отсутствует | отсутствует | |||||
| Пшеница | отсутствует |
Капсулы гелеобразных чехлов устойчивы к реакции окружающей среды. В 0,1 и в 1,0 нормаль-ных растворах НСl и NaOH контуры их длительное время остаются без заметных изменений. Результаты наблюдений показаны в табл. 5.
Таблица 5 Устойчивость корневых чехлов кукурузы, сои и гороха к действию кислоты и щёлочи при t=200C.
| Экспозиция | Кукуруза | Соя | Горох | |||||||||
| NaOH | HCl | NaOH | HCl | NaOH | HCl | |||||||
| 1 н | 0,1 н | 1 н | 0,1 н | 1 н | 0,1 н | 1 н | 0,1 н | 1 н | 0,1 н | 1 н | 0,1 н | |
| 15 минут | + | + | + | + | + | + | + | + | + | + | + | + |
| 30 минут | + | + | + | + | + | + | + | + | + | + | + | + |
| 2 часа | + | + | - | - | + | + | + | + | + | + | + | + |
| 12 часов | - | - | - | - | + | + | + | + | + | + | + | + |
| 24 часа | - | - | + | + | мало | мало | + | + | мало | мало | ||
| 48 часов | мало | мало | мало | мало |
Изучение химического состава корнеоблекающих чехлов проводили следующим способом. Кончики корней опускали на 2 - 3 минуты в горячую или кипящую воду, в которой гелеобразное вещество быстро растворяется. Растительные клетки и другие возможные механические примеси осаждали путем центрифугирования при 10 000 оборотов в минуту на холоду. Низкомолекулярные компоненты раствора отделяли путем диализа через целлофан, после этого к раствору добавляли три объёма этилового спирта, и смесь ставили на ночь в холодильник. Наутро её центрифугировали, выпавший осадок промывали спиртом, высушивали в ацетоне и до исследования хранили в бюксе над хлористым кальцием. Осадок исследовали на рядуглеводистых и азотистых органических соединений. Результаты качественных реакций, приведённые в табл. 6, подтверждают, что гелеобразные вещества корнеоблекаю-щих чехлов кукурузы представляют собой высокомолекулярный полисахарид, не содержащий белка, аминокислот икетоз. (В нём содержится, по-видимому, гемицеллюлоза.)
Важное свойство гелеобразных выделений корней - их токсичность для микроорганизмов. Чем лучше растёт растение, тем сильнее его антибиотические свойства. Токсичность характерна для всех частей растений: для надземных органов—в меньшей мере, в кончиках корней она наибольшая. Токсические свойства сохраняются растением долгое время: пасока у тыквы остается стерильной до 3— 7 суток.
Отрицательное действие свежих или малоразложившихся растительных остатков на рост растений наблюдается нередко при запашке стерни, соломистого навоза, особенно свежеразложившегося пласта и свежезапаханного зелёного удобрения.
Таблица 6 Качественные реакции на наличие в гелеобразном веществе, продуцируемом кончиками корней кукурузы, углеводистых и азотистых органических соединений
| Реакция | Результаты реакции |
| Подобедова - Молиша с ά-нафтолом на углеводы | Резко положительная |
| Селиванова с резорцином на моносахара, содержащие кетозную группу | Отрицательная |
| С нингидрином на аминокислоты | Отрицательная |
| Биуретовая на белок | Отрицательная |
| Люголя на крахмал | Отрицательная |
| То же, но с предварительным добавлением нескольких капель концентрированной H2SO4 | Окрашивается в фиолетовый цвет, характерный для гемицеллюлоз |
Причинами этого, по мнению одних авторов, является недостаток азота, но мнению других — действие нитратов, третьих - дефицит кислорода или большая концентрация углекислоты. Рассмотрим это явление несколько подробнее.
М. М. Кононова провела серию опытов по изучению действия свежихи малоразложившихся корней люцерны на рост растений ячменя. Результатыэкспериментов убедительно иллюстрируют отрицательное влияние на растения ячменя корней люцерны в начальной стадии их гумификации. При оптимальных условиях влажности и температуры вполне достаточно двух недель, чтобы не только погасить вредное влияние начальной стадии гумификации корней люцерны, но и повысить урожайность ячменя но сравнению свариантом «почва + азот» и особенно с контролем. Наилучшее развитие растений и наивысший урожай ячменя наблюдается при длительном сроке разложения корней люцерны, а наиболее слабое развитие ячменя отмечено в вариантах снеразложившимися корнями люцерны. Отрицательное действие свежих корней люцерны начинает сказываться уже в период всхожести семян. При внесении минеральных удобрений в сосуд с неразложившимися корнями люцерны растения ячменя развивались хуже, чем в варианте с одним удобрением.
«Таким образом, - пишет М.М. Кононова, - причина отрицательного влияния на растение неразложившихся и плохо разложившихся растительных остатков значительно более сложна. Она заключается не только в недостатке питательных элементов, так какдополнительное внесение удобрений лишь частично погашает отрицательный эффект. К тому же отрицательное влияние на ячмень неразложившихся корней люцерны начинает сказываться уже на всхожести семян, т.е. тогда, когда растение не должно еще испытывать потребности в питательных элементах почвы».
 Чтобы понять сущность тормозящего действия свежих и «гумусированных» корней люцерны нарост проростков ячменя, мы поставилиспециальный опыт. В дерново-подзолистой почве с NPK выращивали ячмень; когда он начал колоситься, отобрали почву без корней (ризосферу) и в неё посеяли пшеницу. Контролем для последней служила почва с удобрением без ячменя. Методом почвенных пластинок установлено (рис. 4), что на «внеризосферной» почве в фазу выхода в трубку высота растений пшеницы составляла в среднем 27,4 см, на «ризосферной» же — на 46% ниже; масса растений была на 30% меньшей. Худший рост растений пшеницы в «ризосферной» почве обусловливается оставшимися от корней ячменя гeлеобразными выделениями, которые и придают ей токсичность. С токсичностью «ризосферной» почвы связано явление почвоутомления. Минеральные удобрения даже ввысоких дозax не снимают отрицательного влияния почвоутомления.
Чтобы понять сущность тормозящего действия свежих и «гумусированных» корней люцерны нарост проростков ячменя, мы поставилиспециальный опыт. В дерново-подзолистой почве с NPK выращивали ячмень; когда он начал колоситься, отобрали почву без корней (ризосферу) и в неё посеяли пшеницу. Контролем для последней служила почва с удобрением без ячменя. Методом почвенных пластинок установлено (рис. 4), что на «внеризосферной» почве в фазу выхода в трубку высота растений пшеницы составляла в среднем 27,4 см, на «ризосферной» же — на 46% ниже; масса растений была на 30% меньшей. Худший рост растений пшеницы в «ризосферной» почве обусловливается оставшимися от корней ячменя гeлеобразными выделениями, которые и придают ей токсичность. С токсичностью «ризосферной» почвы связано явление почвоутомления. Минеральные удобрения даже ввысоких дозax не снимают отрицательного влияния почвоутомления.
Под воздействиемгелеобразных выделенийкорней частицы «ризосферной» почвы слипаются, почва становится более структурной, обогащается активным гумусом.
Рис. 3 Рост растений пшеницы на фоне
N120, P120, K180: a - на ризосферной (токсич-ной) почве, б- напаровой почве (контроль)