Окислительной модификации подвергаются и молекулы ДНК, и РНК, а также их структурные фрагменты. Так состав компонентов, входящих в ДНК и РНК, близок по химической природе, то и процессы окисления протекающие с ними близки. Однако закрепившиеся окислительные повреждения ДНК являются более существенными для клетки, чем повреждения РНК. Поэтому рассматривать механизмы окислительной трансформации нуклеиновых кислот будем в основном на примере ДНК, подразумевая, что с РНК происходят схожие изменения.
В результате взаимодействия активных форм кислорода (АФК) с молекулой ДНК могут происходить следующие преобразования:
a) структурная модификация азотистых оснований;
b) разрушение пятичленного кольца дезоксирибозы;
c) расщепление фосфодиэфирных связей, что ведет к фрагментации этого полимера.
In vivo окислительное повреждение ДНК вызвано рядом причин, среди которых немаловажная роль принадлежит так называемому окислительному стрессу, характеризующемуся увеличением внутриклеточного уровня АФК. Но даже в нормальных условиях ядерная ДНК постоянно подвергается действию АФК. Около 90000 окислительных повреждений ядерной ДНК происходит в день в одной клетке и устраняется с помощью эффективных механизмов репарации.
Основным источником АФК в клетке является аппарат окислительного фосфорилирования: из-за "утечки" электронов в результате шунтирования электронтранспортной цепи молекулярным кислородом - преимущественно на полувосстановленном коэнзиме Q (убисемихиноне СоQН•). В равновесных условиях реакция окисления молекулярным кислородом этой свободнорадикальной структуры характеризуется необычайно малой для межрадикальных процессов константой скорости: k=40 М-1с-1. Очевидно, что данное обстоятельство является эволюционно отобранным признаком. Однако, даже в пределах физиологической нормы около 2% от утилизируемого в митохондриях кислорода превращается в супероксидный радикал. При избыточном давлении кислорода наблюдается почти линейная зависимость образования О2-• от концентрации О2 в митохондриях. Поэтому окисление митохондриальной ДНК в условиях избыточной продукции АФК протекает на порядок интенсивнее, чем ядерной. Аналогичная ситуация касается и других митохондриальных структур.
Наиболее вероятным инициатором окислительных повреждений ДНК является НО• (образующийся в ходе реакции взаимодействия О2-• и H2О2 с металлами переходной группы, поскольку сами эти окислители не реагируют достаточно эффективно с ДНК). Гидроксильный радикал вызывает разнообразные повреждения дезоксирибозы и оснований в ДНК. Основной мишенью действия этого радикала являются азотистые основания. Объектом атаки гидроксильного радикала в структуре ДНК выступают и фосфатные группировки. Однако их вклад в общую картину деградации этого полимера весьма незначителен. Если значения констант скоростей реакций взаимодействия НО• с углеводами близки к диффузионному пределу (k~109-1010 М-1с-1), то величина аналогичной константы в отношении фосфата составляет только 2⋅106 М-1с-1. Следовательно, скорость взаимодействия этого радикала даже не с основанием, а с углеводным компонентом ДНК будет на много порядков выше, чем с фосфатным (учитывая одинаковое их содержание в структуре этого биополимера).
Первичным продуктом взаимодействия НО• с гуанином, цитозином, аденином и тимином являются их радикальные формы, которые в дальнейшем подвергаются окислительной деструкции, с образованием следующих конечных продуктов:

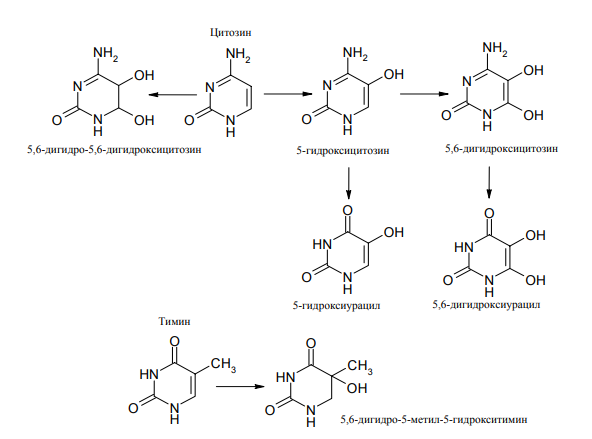
Среди азотистых оснований окислительной деструкции в наибольшей степени подвергается гуанин, модифицированные формы которого составляет около 45% от общего количества окисленных оснований. При взаимодействии гидроксильного радикала с молекулой ДНК в присутствии ионов двухвалентного железа происходит расщепление ее сахарнофосфатного остова и фрагментация. Первичным продуктом такой реакции является радикальная форма С4-углеродного атома дезоксирибозы:

Чувствительность к фрагментации сахарно-фосфатного остова молекулы ДНК оказалась более высокой, чем у полипептидной цепи белков и пептидов вследствие большей экспонированности углевода нуклеиновой кислоты по сравнению с α-углеродным атомом аминокислотных остатков.
Однако, С4-углеродный атом атакует лишь незначительная доля НО• - радикалов (хотя и с очень высокой скоростью: k = 1.9⋅109 М-1с-1). В случае нуклеиновых кислот эти радикалы атакуют азотистые основания пиримидиновой природы с последующим переносом заряда и свободной валентности (свободного катион-радикала) на С4-углеродный атом. После чего процесс фрагментации сахарно-фосфатного остова молекулы ДНК осуществляется по выше приведенной схеме превращений.
Прямая атака С4-углеродного атома с отрывом атома водорода может осуществляться и высоко окисленными оксокомплексами - продуктами взаимодействия молекулярного кислорода с ионами металлов переходной группы. Таким окислителем выступает образовавшийся по гетеролитическому механизму комплекс железа, ион которого формально находится в максимальной степени окисления +5 (FeV=О). Это также ведет к возникновению С4-радикального интермедиата, который затем деградирует в соответствие с двумя конкурирующими между собой процессами:
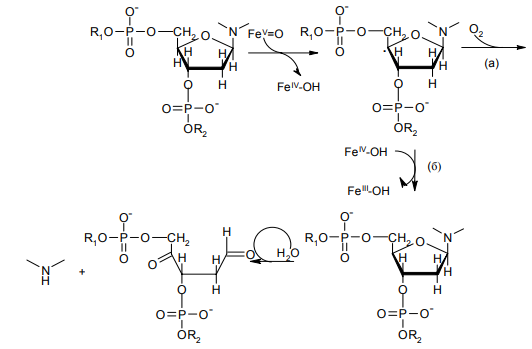
далее превращения идут по пути реакций (а). Выбор между двумя путями последующих превращений этого интермедиата определяется конкуренцией за радикальный центр на С4-углеродном атоме дезоксирибозы между молекулярным кислородом и Fе(IV)ОН (продуктом первоначального взаимодействия оксокомплекса железа с С4-углеродным атомом). Причем, в зависимости от выбора пути превращений, результатом окислительной трансформации нуклеиновой кислоты (помимо ее структурной модификации) будет либо расщепление сахарно-фосфатного остова, либо отщепление азотистого основания (последовательность превращений (б))