Примеры решения задач
Задача 1
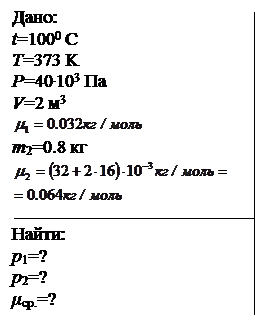 В сосуде при температуре 1000С и давлении 40 кПа находится 2 м3 смеси кислорода и сернистого газа (SO2). Масса сернистого газа 0.8 кг. Определить парциальное давление компонентов смеси и среднюю молярную массу. Относительная атомная масса серы равна 32.
В сосуде при температуре 1000С и давлении 40 кПа находится 2 м3 смеси кислорода и сернистого газа (SO2). Масса сернистого газа 0.8 кг. Определить парциальное давление компонентов смеси и среднюю молярную массу. Относительная атомная масса серы равна 32.
Решение
По закону Дальтона давление смеси газов равно сумме парциальных давлений компонент смеси:
 . (1)
. (1)
Для парциальных давлений кислорода и сернистого газа запишем уравнение Менделеева-Клапейрона:
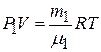 , (2)
, (2)
 . (3)
. (3)
Сложим почленно (2) и (3) и учтём (1):
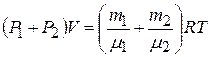 ,
,
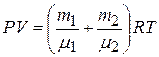 . (4)
. (4)
Запишем уравнение состояния для смеси газов, введя среднюю молярную массу:
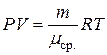 , (5)
, (5)
где 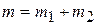 – полная масса смеси.
– полная масса смеси.
Сравнив (4) и (5), получим выражение для средней молярной масс смеси:  , или
, или
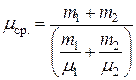 . (6)
. (6)
Из (3) получаем давление P 2:  . Из (1) – давление P 1:
. Из (1) – давление P 1: 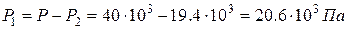 . Уравнение (2) позволит найти массу m 1:
. Уравнение (2) позволит найти массу m 1:  . Теперь по (6) можно рассчитать среднюю молярную массу
. Теперь по (6) можно рассчитать среднюю молярную массу  .
.
Ответ: 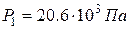 ,
, 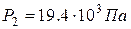 ,
,  .
.
Задача 2.
Найти число молекул хлора в одном кубическом миллиметре при t =500°С и давлении 105 Па, компоненты скорости которых заключены в следующих интервалах: vх=(200÷205) м/с; vу=(100÷110) м/с; vz=(100÷105) м/с. Относительная атомная масса хлора 35.45.
 Решение
Решение
Воспользуемся законом распределения молекул по компонентам скоростей:  , откуда получим вероятность того, что проекция скорости на ось OX лежит в интервале от vх до vх+Δvх равна:
, откуда получим вероятность того, что проекция скорости на ось OX лежит в интервале от vх до vх+Δvх равна:
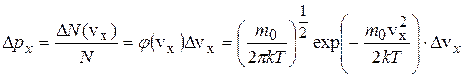 . Аналогично, для проекций скорости vу и vz:
. Аналогично, для проекций скорости vу и vz:
 ;
;  .
.
Здесь было использовано то, что Δvx<<vx, Δvy<<vy, Δvz<<vz.
По закону умножения вероятностей вероятность того, что молекула одновременно имеет все три проекции скоростей в указанных интервалах, равна произведению вероятностей:
 ,
,
откуда искомое число молекул
 .
.
Здесь N – полное число молекул в объёме V: 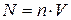 , n – концентрация молекул. Она может быть найдена из уравнения Менделеева-Клапейрона
, n – концентрация молекул. Она может быть найдена из уравнения Менделеева-Клапейрона  . Тогда
. Тогда
 .
.
В последнем выражении остаётся неизвестной только масса одной молекулы; её найдём из закона Авогадро:  . Теперь можно найти искомую величину:
. Теперь можно найти искомую величину:

 .
.
Ответ:  .
.
Задача 3
 Найти среднее число всех соударений, которое происходит в течение 1 с между всеми молекулами в 4 мм3 водорода при нормальных условиях. Эффективный диаметр принять 0.23 нм.
Найти среднее число всех соударений, которое происходит в течение 1 с между всеми молекулами в 4 мм3 водорода при нормальных условиях. Эффективный диаметр принять 0.23 нм.
Решение
Если N – полное число молекул, а  – среднее число соударений в секунду одной молекулы, то искомое полное число соударений в секунду между всеми молекулами равно
– среднее число соударений в секунду одной молекулы, то искомое полное число соударений в секунду между всеми молекулами равно  . Коэффициент
. Коэффициент  учитывает, что в каждом соударении участвуют две молекулы. Средняя арифметическая скорость молекул
учитывает, что в каждом соударении участвуют две молекулы. Средняя арифметическая скорость молекул  , а средняя длина свободного пробега –
, а средняя длина свободного пробега – 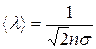 . Здесь
. Здесь  – эффективное сечение молекулы,
– эффективное сечение молекулы, 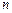 – концентрация молекул. Её можно найти из уравнения Менделеева-Клапейрона
– концентрация молекул. Её можно найти из уравнения Менделеева-Клапейрона 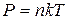 :
:  . Полное число молекул также выразим через концентрацию:
. Полное число молекул также выразим через концентрацию:  . Таким образом, для Z получаем:
. Таким образом, для Z получаем:  . Подставим численные значения:
. Подставим численные значения:
 .
.
Ответ: 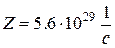 .
.
Задача 4.
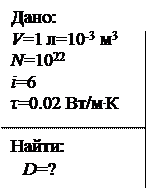 Найти коэффициент диффузии газа, если в объеме 1 л находится 1022 молекул трехатомного газа. Коэффициент теплопроводности 0.02 Вт/м.К.
Найти коэффициент диффузии газа, если в объеме 1 л находится 1022 молекул трехатомного газа. Коэффициент теплопроводности 0.02 Вт/м.К.
Решение
Коэффициент диффузии связан со средней арифметической скоростью молекул газа и средней длиной свободного пробега молекул формулой:  ; а для коэффициента теплопроводности газа имеем:
; а для коэффициента теплопроводности газа имеем: 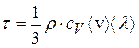 , тогда
, тогда
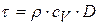 . (1)
. (1)
Здесь  – удельная теплоёмкость газа:
– удельная теплоёмкость газа:
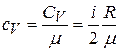 , (2)
, (2)
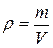 – плотность газа. Поскольку число молей вещества можно записать как
– плотность газа. Поскольку число молей вещества можно записать как  , то
, то  , и
, и
 . (3)
. (3)
Из (1), (2) и (3) получим: 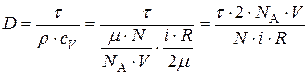 . Подставим
. Подставим
численные значения:  и вычислим размерность:
и вычислим размерность: 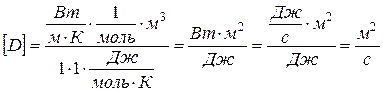 .
.
Ответ: 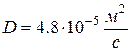 .
.
Задача 5
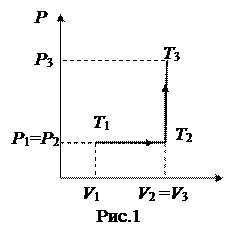 Кислород массой 200 г занимает объем 100 л и находится под давлением 200 кПа. При нагревании газ расширяется при постоянном давлении до объема 300 л, а затем его давление возросло до 500 кПа при неизменном объеме. Найти изменение внутренней энергии газа, совершенную им работу и количество теплоты, переданной газу.
Кислород массой 200 г занимает объем 100 л и находится под давлением 200 кПа. При нагревании газ расширяется при постоянном давлении до объема 300 л, а затем его давление возросло до 500 кПа при неизменном объеме. Найти изменение внутренней энергии газа, совершенную им работу и количество теплоты, переданной газу.
 Решение
Решение
График процесса в осях (P, V) дан на рис.1. Процесс 1→2 изобарный; работа при изобарном процессе равна  . Процесс 2→3 изохорный, и в этом процессе работа не совершается. Таким образом, полная работа
. Процесс 2→3 изохорный, и в этом процессе работа не совершается. Таким образом, полная работа
 . (1)
. (1)
Найдём приращение внутренней энергии при переходе газа из состояния 1 в состояние 3: 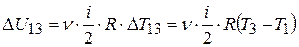 . Преобразуем это выражение и используем уравнение Менделеева-Клапейрона
. Преобразуем это выражение и используем уравнение Менделеева-Клапейрона  для начального и конечного состояний газа:
для начального и конечного состояний газа:  . И, наконец, получим:
. И, наконец, получим:
 . (2)
. (2)
Количество теплоты, переданной газу, найдём из первого начала термодинамики:
 . (3)
. (3)
Подставим в (1), (2) и (3) численные значения:  ,
, 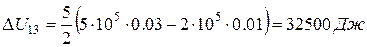 ,
,  .
.
Ответ:  ,
,  ,
, 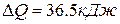 .
.
Задача 6
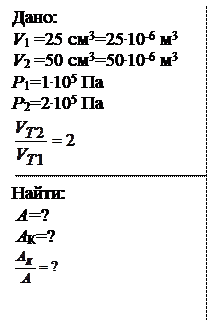 Идеальный газ совершает цикл, состоящий из двух изохор и двух изобар. При этом объем газа изменяется от 25 cм3 до 50 cм3, а давление от 100 кПа до 200 кПа. Найти работу в рассматриваемом цикле, а также работу в цикле Карно, изотермы которого соответствуют наибольшей и наименьшей температурам рассматриваемого цикла, если при изотермическом расширении объем возрастает в 2 раза. Во сколько раз работа в таком цикле меньше работы в цикле Карно?
Идеальный газ совершает цикл, состоящий из двух изохор и двух изобар. При этом объем газа изменяется от 25 cм3 до 50 cм3, а давление от 100 кПа до 200 кПа. Найти работу в рассматриваемом цикле, а также работу в цикле Карно, изотермы которого соответствуют наибольшей и наименьшей температурам рассматриваемого цикла, если при изотермическом расширении объем возрастает в 2 раза. Во сколько раз работа в таком цикле меньше работы в цикле Карно?
Решение
Цикл, состоящий из двух изохор и двух изобар, изображён на рисунке 2 в осях (P, V). Работа A в этом цикле равна сумме работ изобарического расширения и изобарического сжатия, поскольку при изохорных процессах работа не совершается:
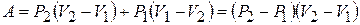 . (1)
. (1)
Максимальная и минимальная температуры рассматриваемого цикла будут в точках с параметрами (P 1, V 1) и (P 2, V 2) соответственно, как следует из уравнения Менделеева-Клапейрона, записанного для этих двух точек:
 (2)
(2)
 . (3)
. (3)
 По условию температуры нагревателя и холодильника в другом цикле – цикле Карно – равны соответственно максимальной и минимальной температуре данного цикла:
По условию температуры нагревателя и холодильника в другом цикле – цикле Карно – равны соответственно максимальной и минимальной температуре данного цикла:
 ,
,  . (4)
. (4)
Работа же изотермического расширения в цикле Карно равна  , а с учётом (3)
, а с учётом (3)  . Поскольку процесс расширения в цикле Карно – изотермический, то внутренняя энергия при этом процессе не изменяется:
. Поскольку процесс расширения в цикле Карно – изотермический, то внутренняя энергия при этом процессе не изменяется: 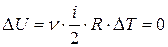 , и по первому закону термодинамики количество теплоты, полученной рабочим телом от нагревателя при этом процессе, равно
, и по первому закону термодинамики количество теплоты, полученной рабочим телом от нагревателя при этом процессе, равно
 . (5)
. (5)
Далее, КПД любого цикла равен 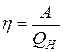 , и, в частности, для цикла Карно:
, и, в частности, для цикла Карно:
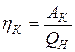 , (6)
, (6)
где А К – искомая полная работа в цикле Карно. С другой стороны, 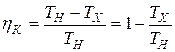 , а с учётом (4)
, а с учётом (4)
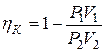 . (7)
. (7)
Из (5), (6) и (7) получим:
 . (8)
. (8)
В (1) и (8) подставим численные значения:
 ;
;
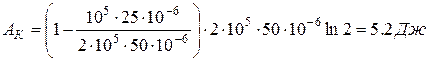 .
.
Найдём отношение работ:  .
.
Ответ:  ;
;  ;
; 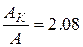 .
.
Задача 7
Найти суммарное изменение энтропии при погружении 100 г нагретого до 3000С железа в воду при температуре 50С. Температуру воды считать постоянной, удельная теплоемкость железа 500 Дж/(кг.К).
 Решение
Решение
Суммарное изменение энтропии воды и железа равно: 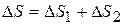 , где
, где 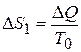 - изменение энтропии для воды, поскольку её температура T 0 остаётся неизменной. Количество теплоты, полученное водой, равно теплоте, отданной железом при охлаждении:
- изменение энтропии для воды, поскольку её температура T 0 остаётся неизменной. Количество теплоты, полученное водой, равно теплоте, отданной железом при охлаждении:  , то есть
, то есть  .
.
Температура железа непостоянна, поэтому изменение энтропии для него  . Подставим
. Подставим 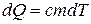 и вычислим интеграл:
и вычислим интеграл: 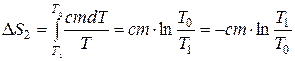 . Полное изменение энтропии:
. Полное изменение энтропии:  , или
, или 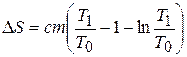 . Подставим численные значения:
. Подставим численные значения:  .
.
Ответ: 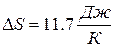 .
.
Задача 8
В сосуде объемом 10 л находится 0.25 кг азота при температуре 270С. 1) Какую часть давления газа составляет давление, обусловленное силами взаимодействия молекул? 2) Какую часть объема сосуда составляет собственный объем молекул?
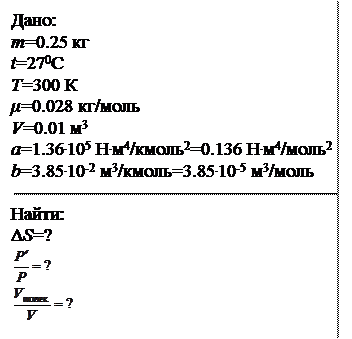 Решение
Решение
В модели Ван-дер-Ваальса молекулы можно считать абсолютно твёрдыми шариками с диаметром, равным эффективному диаметру d эфф. Собственный объём одной молекулы равен: 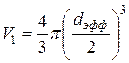 . Суммарный собственный объём всех N молекул, содержащихся в сосуде, будет
. Суммарный собственный объём всех N молекул, содержащихся в сосуде, будет  . Поправка b на собственный объём молекул в уравнении Ван-дер-Ваальса равна учетверённому собственному объёму молекул, содержащихся в одном моле вещества:
. Поправка b на собственный объём молекул в уравнении Ван-дер-Ваальса равна учетверённому собственному объёму молекул, содержащихся в одном моле вещества: 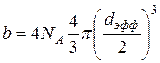 . То есть
. То есть  . Искомое отношение
. Искомое отношение 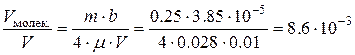 . Давление, обусловленное силами взаимодействия молекул, равно
. Давление, обусловленное силами взаимодействия молекул, равно 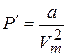 , где
, где  – молярный объём. Давление реального газа P найдём из уравнения Ван-дер-Ваальса
– молярный объём. Давление реального газа P найдём из уравнения Ван-дер-Ваальса  :
:  . Их отношение:
. Их отношение:

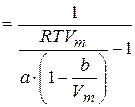
 .
.
Подставим численные значения:
 .
.
Проанализируем полученные величины. Собственный объём молекул занимает менее 1% объёма сосуда:  , следовательно, в уравнении Ван-дер-Ваальса для данного газа можно было бы пренебречь поправкой b. Поправкой же a пренебрегать не следует, так как давление, обусловленное силами взаимодействия молекул, составляет около 5% давления газа:
, следовательно, в уравнении Ван-дер-Ваальса для данного газа можно было бы пренебречь поправкой b. Поправкой же a пренебрегать не следует, так как давление, обусловленное силами взаимодействия молекул, составляет около 5% давления газа:  .
.
Ответ:  ;
;  .
.
Задача 9
 Пользуясь классической теорией теплоемкости, найти, из какого материала сделан металлический шарик массой 25 г, если для его нагревания от 100С до 300С потребовалось 117 Дж теплоты.
Пользуясь классической теорией теплоемкости, найти, из какого материала сделан металлический шарик массой 25 г, если для его нагревания от 100С до 300С потребовалось 117 Дж теплоты.
Решение
Количество теплоты, необходимой для нагрева шарика, равно  , где удельная теплоёмкость с связана с молярной С соотношением:
, где удельная теплоёмкость с связана с молярной С соотношением: 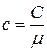 . По закону Дюлонга и Пти молярная теплоёмкость равна
. По закону Дюлонга и Пти молярная теплоёмкость равна  , где z – число атомов в молекуле и для металла равно 1. Таким образом, получим:
, где z – число атомов в молекуле и для металла равно 1. Таким образом, получим:  ,
, 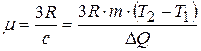 . Подставим численные значения:
. Подставим численные значения: 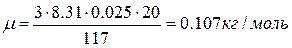 . По таблице Менделеева находим металл с относительной атомной массой 107: это серебро.
. По таблице Менделеева находим металл с относительной атомной массой 107: это серебро.
Ответ: шарик сделан из серебра (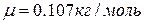 ).
).
Задача 10
Медная проволока натянута горячей при температуре 1500С между двумя прочными неподвижными стенами. При какой температуре, остывая, проволока разорвется? Считать, что закон Гука выполняется вплоть до разрыва проволоки.
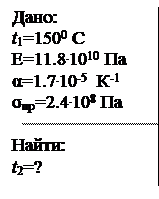 Решение
Решение
Длина нагретой проволоки при температуре t 1 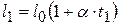 ; при этом проволока не деформирована (не натянута). Длина остывшей до искомой температуры ненатянутой проволоки
; при этом проволока не деформирована (не натянута). Длина остывшей до искомой температуры ненатянутой проволоки 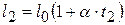 . Но, поскольку проволока закреплена между неподвижными стенами, она оказывается растянутой на
. Но, поскольку проволока закреплена между неподвижными стенами, она оказывается растянутой на 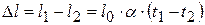 . По закону Гука
. По закону Гука  , где
, где  – относительное удлинение, σ=σпр. – механическое напряжение. Тогда
– относительное удлинение, σ=σпр. – механическое напряжение. Тогда 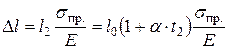 ; или
; или  , откуда
, откуда 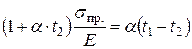 , и
, и 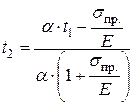 . Далее,
. Далее,  . Подставим численные значения:
. Подставим численные значения: 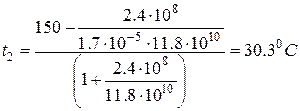 .
.
Ответ: 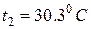 .
.