Квантовые св-са элек.маг. излучения.Гипотеза квантов Планка
Впервые это было осознано при рассмотрении проблемы теплового излучения. Немецким физиком Вильгельмом Вином в 1896 г. была получена формула для описания распределения энергии в спектре равновесного излучения (формула Вина):
 , (2.1)
, (2.1)
где  – спектральная плотность энергии излучения, приходящаяся на единичный интервал частот, С1 и С2 – постоянные коэффициенты. Эта формула хорошо согласовывалась с результатами экспериментальных исследований при больших частотах (малых длинах волн). В низкочастотном пределе попытка применения этого выражения оказалась неудачной, т.к. при
– спектральная плотность энергии излучения, приходящаяся на единичный интервал частот, С1 и С2 – постоянные коэффициенты. Эта формула хорошо согласовывалась с результатами экспериментальных исследований при больших частотах (малых длинах волн). В низкочастотном пределе попытка применения этого выражения оказалась неудачной, т.к. при  спектральная плотность энергии излучения, приходящаяся на единичный интервал частот, должна неограниченно возрастать (рисунок 2.1).
спектральная плотность энергии излучения, приходящаяся на единичный интервал частот, должна неограниченно возрастать (рисунок 2.1).
В 1900 г. Дж.У. Рэлеем на основе классических представлений о равномерном распределении энергии по степеням свободы, а в 1905 – 1909 гг. Дж Джинс на основе применения методов статистической физики получили закон распределения энергии в спектре абсолютно чёрного тела (формула Рэлея – Джинса):
 , (2.2)
, (2.2)
где k – постоянная Больцмана. Эта формула хорошо согласуется с экспериментальными данными лишь при малых частотах (в длинноволновой области спектра). На рисунке 2.1 видно, что с ростом частоты спектральная плотность энергии излучения  , приходящаяся на единичный интервал частот, в соответствии с формулой Рэлея – Джинса должна неограниченно расти (ультрафиолетовая катастрофа).
, приходящаяся на единичный интервал частот, в соответствии с формулой Рэлея – Джинса должна неограниченно расти (ультрафиолетовая катастрофа).
В 1900 г. немецкий физик Макс Планк получил функцию спектрального распределения энергии теплового излучения, которая хорошо согласовывалась с экспериментальными результатами. В 1905 г. для её теоретического обоснования он использовал чуждые классической физике предположения: вещество он рассматривал как совокупность гармонических осцилляторов. Энергия осциллятора определяется по формуле:  , где
, где  – частота колебаний осциллятора,
– частота колебаний осциллятора,  – постоянная Планка, имеющая размерность действия (измеряется в Дж·с).
– постоянная Планка, имеющая размерность действия (измеряется в Дж·с).
Рассматривая в состоянии равновесия замкнутую систему «вещество – излучение», энергия которой равна Е, Планк предположил, что вещество состоит из гармонических осцилляторов, колеблющихся с частотой  ,
,  , …,
, …,  , число которых в системе равно соответственно N1, N2, …, Nn. Энергия каждого осциллятора прямо пропорциональна частоте его колебаний:
, число которых в системе равно соответственно N1, N2, …, Nn. Энергия каждого осциллятора прямо пропорциональна частоте его колебаний:  . Поэтому энергия всех осцилляторов (энергия вещества, в котором имеется N = N1 + N2 + … + Nn осцилляторов) равна
. Поэтому энергия всех осцилляторов (энергия вещества, в котором имеется N = N1 + N2 + … + Nn осцилляторов) равна 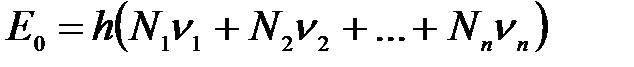 , и энергия равновесного излучения
, и энергия равновесного излучения  . Функция спектрального распределения энергии равновесного излучения получена Планком в 1905 году.
. Функция спектрального распределения энергии равновесного излучения получена Планком в 1905 году.
Формула Планка используется для определения объемной спектральной плотности излучения  и пропорциональной ей спектральной плотности излучения, испускаемого в единичном интервале длин волн с единицы площади поверхности тела,
и пропорциональной ей спектральной плотности излучения, испускаемого в единичном интервале длин волн с единицы площади поверхности тела, 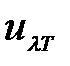 :
:
 . (2.3)
. (2.3)
5. Модели строения квантов в доквантовой физике. В 1904 году Дж. Дж. Томсон предложил модель, получившую название «капельной». В соответствии с этой моделью атом представляет собой положительно заряженный шар, в который вкраплено некоторое количество электронов, достаточное для того, чтобы атом в целом оставался электрически нейтральным. Электроны под действием квазиупругих сил находятся в состоянии непрерывного колебательного движения; в результате этих колебаний атом излучает электромагнитные волны. Идея о колебательном характере движения заряженных частиц оказалась успешной при объяснении ряда явлений. Например, дисперсию света удалось достаточно строго описать на основе представления о квазиупруго связанном электроне. Тем не менее, в модели Томсона обнаружились и уязвимые моменты. Неясным оставалось, почему, вопреки требованиям электродинамики, положительно заряженная материя не разлетается из-за взаимного отталкивания ее частей, откуда берутся положительно заряженные  -частицы при радиоактивном распаде атомов и т.д.
-частицы при радиоактивном распаде атомов и т.д.
Попытку выяснить характер распределения положительных и отрицательных частиц в атоме предпринял один из учеников Томсона – английский физик Э. Резерфорд. В 1906 году при изучении прохождения  -частиц через вещество он обнаружил их рассеяние и установил закон рассеяния
-частиц через вещество он обнаружил их рассеяние и установил закон рассеяния  -частиц атомами различных элементов. В 1911 году на основании результатов исследования рассеяния
-частиц атомами различных элементов. В 1911 году на основании результатов исследования рассеяния  -частиц веществом Резерфордом была предложена модель атома, названная планетарной. В соответствии с этой моделью атом состоит из положительно заряженного ядра и окружающей его электронной оболочки. Линейные размеры ядра порядка
-частиц веществом Резерфордом была предложена модель атома, названная планетарной. В соответствии с этой моделью атом состоит из положительно заряженного ядра и окружающей его электронной оболочки. Линейные размеры ядра порядка 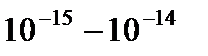 м, линейные размеры атома, определяемые электронной оболочкой, – порядка
м, линейные размеры атома, определяемые электронной оболочкой, – порядка 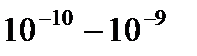 м. Практически вся масса атома (~99,95 %) сосредоточена в ядре. Электронная оболочка состоит из
м. Практически вся масса атома (~99,95 %) сосредоточена в ядре. Электронная оболочка состоит из  электронов (
электронов ( – порядковый номер элемента в периодической системе элементов Д.И. Менделеева), движущихся по замкнутым траекториям (орбитам) относительно ядра. В силу электрической нейтральности атома ядро имеет заряд
– порядковый номер элемента в периодической системе элементов Д.И. Менделеева), движущихся по замкнутым траекториям (орбитам) относительно ядра. В силу электрической нейтральности атома ядро имеет заряд  , где
, где  – положительный электрический заряд, равный по абсолютной величине заряду электрона. Впоследствии, с накоплением экспериментального материала, планетарная модель была уточнена. В 1920 году после открытия изотопов (Содди, Томсон, Астон), экспериментального наблюдения ядер водорода, выбитых из ядер других элементов, Резерфордом введено понятие протона. В 1930 году учеником Резерфорда Чедвиком открыта частица, названная нейтроном. В 1932 году немецкий физик-теоретик В. К. Гейзенберг и российский физик-теоретик Д. Д. Иваненко конкретизировали планетарную модель атома. Согласно их выводам, ядро атома состоит из
– положительный электрический заряд, равный по абсолютной величине заряду электрона. Впоследствии, с накоплением экспериментального материала, планетарная модель была уточнена. В 1920 году после открытия изотопов (Содди, Томсон, Астон), экспериментального наблюдения ядер водорода, выбитых из ядер других элементов, Резерфордом введено понятие протона. В 1930 году учеником Резерфорда Чедвиком открыта частица, названная нейтроном. В 1932 году немецкий физик-теоретик В. К. Гейзенберг и российский физик-теоретик Д. Д. Иваненко конкретизировали планетарную модель атома. Согласно их выводам, ядро атома состоит из  протонов и некоторого числа нейтронов. Атомы, отличающиеся только числом нейтронов в ядре, а следовательно, массой, названы изотопами. Относительно ядра по замкнутым траекториям движутся
протонов и некоторого числа нейтронов. Атомы, отличающиеся только числом нейтронов в ядре, а следовательно, массой, названы изотопами. Относительно ядра по замкнутым траекториям движутся  электронов.
электронов.
Центральное место в теории строения атома занимает проблема испускания и поглощения электромагнитного излучения, поскольку именно излучение доставляет исследователю наибольшее количество информации о внутреннем устройстве атома. На рубеже XIX-XX веков процессы испускания электромагнитного излучения атомами описывались в рамках классической электродинамики. Согласно классической электродинамике, ускоренно движущийся заряд излучает электромагнитные волны. Вращающийся относительно ядра электрон движется с ускорением, а потому должен непрерывно излучать. Теряя энергию на излучение, электрон должен непрерывно приближаться к ядру и, в конце концов, упасть на него. При этом частота обращения электрона вокруг ядра, а следовательно, и частота испускаемого электроном электромагнитного излучения должны непрерывно возрастать, то есть спектр излучения атома должен быть непрерывным.
Следовательно, на основе модели Резерфорда в рамках классического рассмотрения не только не объясняется линейчатый характер атомных спектров и закономерности в них, но и практически отвергается стабильность атома. Не согласующийся с опытом вывод о неустойчивости атома есть результат применения классической физики к явлениям микромира. Решение проблем, связанных со строением атомных систем и описанием их состояний, было получено только в рамках квантовых представлений. Таким образом, теоретической основой современной физики атома является квантовая механика.
6. Сериальные закон-ти в спектрах водор-ых с-ем. Обобщ. ф-ла Бальмера В частности, в 1895 году Бальмером в видимой области спектра водорода были обнаружены спектральные линии, волновые числа которых 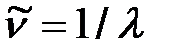 удовлетворяют условию
удовлетворяют условию  ,
,
где 
 см-1 – постоянная Ридберга;
см-1 – постоянная Ридберга;  3, 4, 5, … Указанная совокупность спектральных линий названа серией Бальмера. С учетом результатов последующих экспериментальных исследований, проведенных в более широкой спектральной области излучения атомов водорода, сериальные закономерности были обобщены в виде обобщенной формулы Бальмера:
3, 4, 5, … Указанная совокупность спектральных линий названа серией Бальмера. С учетом результатов последующих экспериментальных исследований, проведенных в более широкой спектральной области излучения атомов водорода, сериальные закономерности были обобщены в виде обобщенной формулы Бальмера:

(здесь  1, 2, 3,…;
1, 2, 3,…; 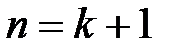 ,
,  ,…). По обобщенной формуле Бальмера могут быть рассчитаны волновые числа всех спектральных линий водорода.
,…). По обобщенной формуле Бальмера могут быть рассчитаны волновые числа всех спектральных линий водорода.
При  из всего спектра атома выделяется определенная спектральная серия:
из всего спектра атома выделяется определенная спектральная серия:
 соответствует серия Лаймана,
соответствует серия Лаймана,
 - серия Бальмера,
- серия Бальмера,
 - серия Пашена,
- серия Пашена,
 - серия Брэкета,
- серия Брэкета,
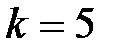 - серия Пфунда и т.д.
- серия Пфунда и т.д.
При  волновое число в пределах каждой спектральной серии стремится к значению, определяемому выражением
волновое число в пределах каждой спектральной серии стремится к значению, определяемому выражением  и называемому границей серии. Волновое число головной линии спектральной серии определяется по формуле
и называемому границей серии. Волновое число головной линии спектральной серии определяется по формуле  .
.
7. Комбинац-ый принцип Ритца и его практическое применение Итогом анализа экспериментальных результатов и их обобщения стала формулировка комбинационного принципа Ритца, согласно которому волновое число каждой спектральной линии в спектре любого атома можно представить как разность двух спектральных термов:  . (3.2)
. (3.2)
Для атома водорода спектральный терм записывается в виде  .
.
Из комбинационного принципа Ритца вытекает следствие: разность волновых чисел двух спектральных линий одной серии есть не что иное, как волновое число спектральной линии, принадлежащей другой серии того же атома.[1]
8.Постулаты Бора. Нильс Бор в своей теории с большим искусством увязал модель атома Резерфорда, эмпирически установленные закономерности в спектрах атомов и квантовые представления об излучении. В основу новой модели атома Н. Бор положил два сформулированных им в 1913 году постулата:
1. Атомы могут длительное время, не испуская и не поглощая энергии, находиться в определенных стационарных состояниях; соответствующие этим состояниям энергии  ,
, 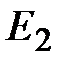 ,
,  , … образуют дискретный спектр значений.
, … образуют дискретный спектр значений.
2. При переходе атома из одного стационарного состояния, с энергией  , в другое, с энергией
, в другое, с энергией  , происходит испускание или поглощение кванта с частотой
, происходит испускание или поглощение кванта с частотой
 . (3.3)
. (3.3)
Здесь 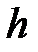 - постоянная Планка.
- постоянная Планка.
Применяя правило частот Бора (3.3), можно объяснить комбинационный принцип Ритца. Из (1.2) и (1.3) получаем:
 ,
,
то есть  . Тем самым раскрывается физический смысл спектральных термов: они характеризуют энергию атома в стационарных состояниях.
. Тем самым раскрывается физический смысл спектральных термов: они характеризуют энергию атома в стационарных состояниях.
9. Теория Бора для волор-ых атомных с-ем. Достоинства и недостатки Т.Бора Основываясь на сформулированных выше квантовых постулатах, Бор построил теорию, в которой объясняются сериальные закономерности в спектре атома водорода. Им, в соответствии с моделью Резерфорда, рассматривался так называемый водородоподобный атом, то есть система, состоящая из ядра с зарядом  и одного электрона. При
и одного электрона. При  = 1 такая система представляет собой атом водорода, при
= 1 такая система представляет собой атом водорода, при  = 2 – однократно ионизированный атом гелия (ион
= 2 – однократно ионизированный атом гелия (ион 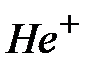 ), при
), при  = 3 – двукратно ионизированный атом лития (ион
= 3 – двукратно ионизированный атом лития (ион 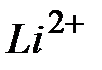 ) и т.д. Для простоты Бор считал, что электрон движется относительно покоящегося ядра по круговой орбите. Бором было принято, что стационарными являются лишь те орбиты, при движении по которым момент импульса электрона
) и т.д. Для простоты Бор считал, что электрон движется относительно покоящегося ядра по круговой орбите. Бором было принято, что стационарными являются лишь те орбиты, при движении по которым момент импульса электрона  удовлетворяет условию квантования круговых орбит: модуль момента импульса электрона кратен приведенной постоянной Планка
удовлетворяет условию квантования круговых орбит: модуль момента импульса электрона кратен приведенной постоянной Планка  , то есть для
, то есть для 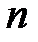 -й орбиты можно записать:
-й орбиты можно записать:  , (3.4)
, (3.4)
где 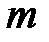 ,
, 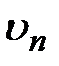 и
и  – соответственно масса, модуль линейной скорости движения электрона по
– соответственно масса, модуль линейной скорости движения электрона по 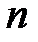 -й орбите и ее радиус;
-й орбите и ее радиус;  = 1, 2, 3…
= 1, 2, 3…
Нетрудно найти полную энергию 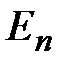 электрона на
электрона на  -й орбите:
-й орбите:  ,
,
где 
– кинетическая энергия электрона на  -й орбите,
-й орбите, 
– потенциальная энергия кулоновского взаимодействия электрона с ядром. Здесь  в системе СГС,
в системе СГС,  в системе СИ.Второй закон Ньютона для электрона, движущегося по
в системе СИ.Второй закон Ньютона для электрона, движущегося по  -й круговой орбите, имеет вид:
-й круговой орбите, имеет вид:  . Решая совместно (3.4) и (3.8), получим выражение для радиуса орбиты электрона:
. Решая совместно (3.4) и (3.8), получим выражение для радиуса орбиты электрона:  . (3.9)Радиус первой орбиты (
. (3.9)Радиус первой орбиты ( =1) электрона в атоме водорода (
=1) электрона в атоме водорода ( =1) равен
=1) равен  м и называется первым боровским радиусом. Из (3.4) с учетом (3.9) для скорости
м и называется первым боровским радиусом. Из (3.4) с учетом (3.9) для скорости 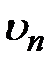 получим:
получим:  . (3.10)Воспользовавшись формулами (3.5) – (3.7), в которых
. (3.10)Воспользовавшись формулами (3.5) – (3.7), в которых  и
и 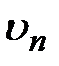 определяются выражениями (3.9) и (3.10), найдем энергию электрона в
определяются выражениями (3.9) и (3.10), найдем энергию электрона в  -м стационарном состоянии
-м стационарном состоянии  :
:  . (3.11)Целое число
. (3.11)Целое число  называется квантовым числом, а формула (3.11) представляет собой правило квантования энергии электрона в водородоподобном атоме. Так как состояние водородоподобной системы полностью определяется состоянием её единственного электрона, то формулу (3.11) можно рассматривать как закон квантования энергии атома в целом.Пользуясь правилом частот Бора (3.3) и выражением (3.11), найдем волновое число спектральной линии, соответствующей в спектре квантовому переходу атома из стационарного состояния с энергией
называется квантовым числом, а формула (3.11) представляет собой правило квантования энергии электрона в водородоподобном атоме. Так как состояние водородоподобной системы полностью определяется состоянием её единственного электрона, то формулу (3.11) можно рассматривать как закон квантования энергии атома в целом.Пользуясь правилом частот Бора (3.3) и выражением (3.11), найдем волновое число спектральной линии, соответствующей в спектре квантовому переходу атома из стационарного состояния с энергией 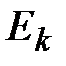 в стационарное состояние с энергией
в стационарное состояние с энергией  :
:
 . (3.12)
. (3.12)
Полученное в рамках теории Бора выражение (3.12) для атома водорода совпадает с эмпирической обобщенной формулой Бальмера (3.1), что можно считать большим успехом теории Бора. Сравнивая (3.1) и (3.12), находим:
 (м-1).
(м-1).
Отличие теоретического значения постоянной Ридберга  от экспериментального (
от экспериментального ( = 10967758 м-1) обусловлено тем, что при выводе формулы (3.12) ядро атома считалось неподвижным, что возможно, если его масса бесконечно велика по сравнению с массой электрона. При учете конечности массы ядра
= 10967758 м-1) обусловлено тем, что при выводе формулы (3.12) ядро атома считалось неподвижным, что возможно, если его масса бесконечно велика по сравнению с массой электрона. При учете конечности массы ядра 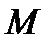 необходимо рассматривать движение системы электрон + ядро относительно ее центра масс. Тогда, как показано в механике, такая система характеризуется приведенной массой
необходимо рассматривать движение системы электрон + ядро относительно ее центра масс. Тогда, как показано в механике, такая система характеризуется приведенной массой  . С учётом этого постоянную Ридберга можно представить в виде:
. С учётом этого постоянную Ридберга можно представить в виде:  .
.
Самым главным недостатком теории Бора явилась ее внутренняя противоречивость. В теории Бора постулировалось существование квантованных стационарных состояний электрона, что было непонятным с позиций классической механики; и вместе с тем для описания движения электронов в стационарных состояниях применялись именно законы классической механики, хотя классическая электродинамика считалась неприменимой.
10. Квантование эллиптических орбит по Зоммерфельду Кинетическая энергия электрона, движущегося по эллиптической орбите,  . Сопряженные с
. Сопряженные с  и
и  импульсы определяются формулами:
импульсы определяются формулами:  ,
,  . Потенциальная энергия
. Потенциальная энергия 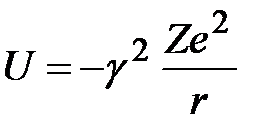 .
.
Выражая  и
и  через
через  и
и 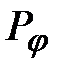 , полную энергию электрона представим в виде:
, полную энергию электрона представим в виде:
 .
.
Так как потенциальная энергия  не зависит от
не зависит от  , то
, то  ,
,  (
( – модуль момента импульса электрона). Тогда
– модуль момента импульса электрона). Тогда 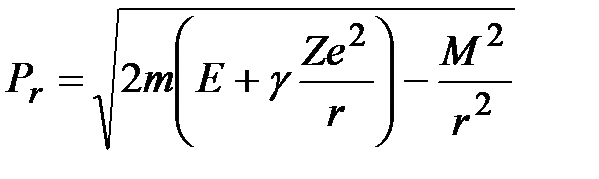 . В соответствии с правилами квантования Бора – Зоммерфельда [2]
. В соответствии с правилами квантования Бора – Зоммерфельда [2]
 ,
,
 ,
,
где 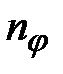 – азимутальное квантовое число,
– азимутальное квантовое число,  – радиальное квантовое число. Азимутальным квантовым числом определяется модуль момента импульса электрона:
– радиальное квантовое число. Азимутальным квантовым числом определяется модуль момента импульса электрона:  .
.
Из решения задачи Кеплера следуют выражения для энергии электрона  , длины большой
, длины большой  и малой
и малой 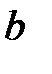 полуосей эллиптической орбиты:
полуосей эллиптической орбиты:
 , (3.13)
, (3.13)
 , (3.14)
, (3.14)
 , (3.15)
, (3.15)
где  – главное квантовое число,
– главное квантовое число,  – первый боровский радиус.
– первый боровский радиус.
Как видно из (3.11) и (3.13), при движении электрона – как по круговой, так и по эллиптической орбите – его энергия определяется главным квантовым числом  , и не зависит от радиального и азимутального квантовых чисел, взятых по отдельности.
, и не зависит от радиального и азимутального квантовых чисел, взятых по отдельности.
Анализируя формулы (3.14) и (3.15), видим, что азимутальное квантовое число, с одной стороны, не может превышать значения главного квантового числа, а с другой – не может принимать значения, равного нулю, так как в этом случае эллиптическая орбита трансформируется в линию, проходящую через ядро атома, что лишено физического смысла. Таким образом, получаем:  = 1, 2, …,
= 1, 2, …,  .
.
11.Изотопический сдвиг Ридберга можно представить в виде:
 .
.
В этом приближении расчётное значение постоянной Ридберга ещё лучше согласуется с экспериментальным. Как видим, постоянная Ридберга зависит от массы ядра. Так как значения постоянной Ридберга для разных изотопов одного и того же элемента неодинаковы, волновые числа, соответствующие в спектрах изотопов заданным числам  и
и 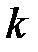 , различны. Это приводит к смещению спектральных линий изотопов, называемому изотопическим сдвигом [3].
, различны. Это приводит к смещению спектральных линий изотопов, называемому изотопическим сдвигом [3].
12.Внеш. фотоэф-т. Эмпирич. з-ны Столетова. Гипотеза квантов Эйнштейна. Внут. фотоэф-т Явление вырывания электронов с поверхности вещества под действием электромагнитного излучения называется внешним фотоэффектом. Фотоэлектрическими свойствами обладают металлы, полупроводники, а также диэлектрики и электролиты. Внутренний фотоэффект состоит в увеличении концентрации свободных носителей заряда в веществе под действием электромагнитного излучения. Внутренний фотоэффект может происходить в полупроводниках и диэлектриках.
Явление внешнего фотоэффекта было открыто в 1887 году Герцем и экспериментально исследовано Хальваксом, Риги, Столетовым и другими учеными. Принципиальная схема экспериментальной установки показана на рисунке 2.2.

Типичный вид вольтамперной характеристики вакуумного фотоэлемента, регистрируемой при заданных характеристиках электромагнитного излучения, показан на рисунке 2.3.
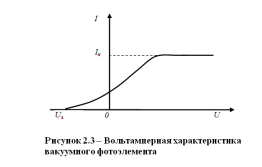
Характерными параметрами вольтамперной характеристики фотоэлемента являются сила фототока насыщения  и запирающий потенциал
и запирающий потенциал  . Запирающим потенциалом называется такое максимальное значение отрицательного потенциала, при котором сила фототока становится равной нулю (смотри рисунок 2.3).
. Запирающим потенциалом называется такое максимальное значение отрицательного потенциала, при котором сила фототока становится равной нулю (смотри рисунок 2.3).
А.Г Столетовым в 1888 году эмпирически были установлены следующие основные законы фотоэффекта:
1. Сила фототока насыщения (при прочих равных условиях) пропорциональна падающему световому потоку. (Нужно иметь в виду, что фотоэффект вызывается поглощенным излучением.)
2. Фотоэффект наблюдается лишь при освещении фотокатода излучением, частота 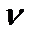 которого не менее частоты
которого не менее частоты  красной границы фотоэффекта (в шкале длин волн – если λ
красной границы фотоэффекта (в шкале длин волн – если λ  λ0).
λ0).
3. Распределение фотоэлектронов по начальным значениям кинетической энергии не зависит от величины светового потока.
4. Максимальная начальная кинетическая энергия фотоэлектронов линейно зависит от частоты излучения:
 . (2.4)
. (2.4)
Числовые значения величины a различны для различных материалов, а b – постоянная величина.
5. Фотоэффект – явление практически безынерционное.
Попытка объяснить механизм фотоэффекта на основе электромагнитной теории света оказалась несостоятельной и привела к противоречиям с экспериментальными результатами. Эмпирически установленные законы фотоэффекта были объяснены лишь с позиций квантовой теории.
Для объяснения явления фотоэффекта в 1905 году Эйнштейн предположил, что поток энергии электромагнитного излучения не является непрерывным, а состоит из дискретных порций энергии, называемых квантами или фотонами. В этом и состоит суть гипотезы квантов Эйнштейна, который развил квантовую гипотезу Планка.
Согласно квантовой теории света, энергия фотона  , поглощенного фотокатодом, расходуется на совершение работы A1 по отрыву электрона от атома (в неметаллах), совершение электроном работы выхода A2 за пределы поверхности материала и сообщение электрону кинетической энергии
, поглощенного фотокатодом, расходуется на совершение работы A1 по отрыву электрона от атома (в неметаллах), совершение электроном работы выхода A2 за пределы поверхности материала и сообщение электрону кинетической энергии  :
:
 . (2.5)
. (2.5)
Соотношение (2.5), называемое уравнением Эйнштейна для фотоэффекта, представляет собой закон сохранения энергии для данного явления, рассматриваемого на элементарном уровне. Если  , то внешний фотоэффект не наблюдается. Красная граница фотоэффекта
, то внешний фотоэффект не наблюдается. Красная граница фотоэффекта  определяется из условия
определяется из условия  (для металлов A1=0 и hν0=A2). Поскольку работа выхода различна для электронов, находящихся на разной глубине в приповерхностном слое фотокатода, то существует некоторое распределение фотоэлектронов по скоростям (кинетическим энергиям). Характер этого распределения можно определить графическим дифференцированием вольтамперной кривой фотоэффекта I=I(U) в области тормозящих напряжений (рисунок 2.3). При достижении запирающего напряжения UЗ выполняется условие
(для металлов A1=0 и hν0=A2). Поскольку работа выхода различна для электронов, находящихся на разной глубине в приповерхностном слое фотокатода, то существует некоторое распределение фотоэлектронов по скоростям (кинетическим энергиям). Характер этого распределения можно определить графическим дифференцированием вольтамперной кривой фотоэффекта I=I(U) в области тормозящих напряжений (рисунок 2.3). При достижении запирающего напряжения UЗ выполняется условие
 , (2.6)
, (2.6)
и фототок прекращается.
Использование квантовых представлений о природе электромагнитного излучения позволило успешно объяснить эмпирические закономерности внешнего фотоэффекта.
13.Эффект Комптона и его особенности Столь же плодотворным оказалось использование квантовых представлений при описании эффекта Комптона, заключающегося в изменении длины волны при рассеянии жесткого рентгеновского излучения веществом. Величина изменения длины волны  получила название комптоновского смещения. Объяснение этого эффекта было дано Комптоном и Дебаем с использованием квантовых представлений о том, что фотон обладает энергией
получила название комптоновского смещения. Объяснение этого эффекта было дано Комптоном и Дебаем с использованием квантовых представлений о том, что фотон обладает энергией  и импульсом
и импульсом  в рамках специальной теории относительности.
в рамках специальной теории относительности.
Комптоновское смещение определяется по формуле  , (2.7)
, (2.7)
где  – длина волны падающего излучения,
– длина волны падающего излучения,  - длина волны рассеянного излучения,
- длина волны рассеянного излучения,  – угол рассеяния,
– угол рассеяния, 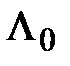
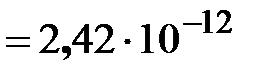 м – постоянная Комптона,
м – постоянная Комптона,  – масса электрона. Правильность формулы (2.7) подтверждается результатами экспериментов, выполненных Симоном, Боте, Гейгером, Якобсеном. Скобельцын Д.В., наблюдавший электроны отдачи в камере Вильсона, помещенной в сильное магнитное поле, при облучении её
– масса электрона. Правильность формулы (2.7) подтверждается результатами экспериментов, выполненных Симоном, Боте, Гейгером, Якобсеном. Скобельцын Д.В., наблюдавший электроны отдачи в камере Вильсона, помещенной в сильное магнитное поле, при облучении её  -лучами, определил энергию и импульс электронов отдачи и доказал, что электроны отдачи – релятивистские частицы.
-лучами, определил энергию и импульс электронов отдачи и доказал, что электроны отдачи – релятивистские частицы.
В соответствии с моделью Комптона и Дебая рассеяние рентгеновского кванта с изменением длины волны является результатом одиночного акта взаимодействия этого кванта с электроном. Поскольку энергия связи электрона с атомом мала по сравнению с энергией рентгеновского кванта (что справедливо для легких атомов), электрон до взаимодействия можно считать свободным и покоящимся. При таких условиях рассматриваемую систему можно описать на основе законов сохранения энергии и импульса (рисунок 2.4).
Обозначим соответственно:
 ;
; 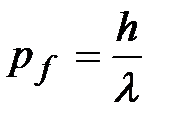 – энергию и импульс падающего кванта с частотой
– энергию и импульс падающего кванта с частотой  (длиной волны
(длиной волны  );
);
 ;
;  – энергию и импульс рассеянного кванта с частотой
– энергию и импульс рассеянного кванта с частотой  (длиной волны
(длиной волны  );
);
 – энергию покоя электрона (m0 – масса электрона);
– энергию покоя электрона (m0 – масса электрона);
 ;
;  – энергию и модуль импульса электрона после взаимодействия с квантом (электрона отдачи).
– энергию и модуль импульса электрона после взаимодействия с квантом (электрона отдачи).

В соответствии с законами сохранения энергии и импульса запишем:
 , (2.8)
, (2.8)
 . (2.9)
. (2.9)
Учитывая связь между энергией и импульсом для фотона и электрона отдачи, выражая энергии и модули импульсов фотона через длины волн  и
и  , из уравнений (2.8), (2.9) находим
, из уравнений (2.8), (2.9) находим
 . (2.10)
. (2.10)
Видим, что эмпирическая формула для комптоновского смещения (2.7) и теоретически полученная формула (2.10) совпадают при условии
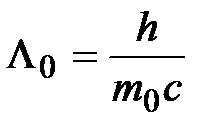 . (2.11)
. (2.11)
Величина 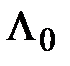 называется комптоновской длиной волны электрона.
называется комптоновской длиной волны электрона.
Численное значение величины  , полученное на основе экспериментальных результатов, и значение, рассчитанное по формуле (2.11), находятся в хорошем соответствии, что рассматривается как подтверждение правильности представлений о корпускулярных свойствах электромагнитного излучения.
, полученное на основе экспериментальных результатов, и значение, рассчитанное по формуле (2.11), находятся в хорошем соответствии, что рассматривается как подтверждение правильности представлений о корпускулярных свойствах электромагнитного излучения.
14.Гипотеза волн де Бройля. С-ва его волн Французский ученый Луи де Бройль в 1924 году высказал идею о том, что частицы вещества обладают и корпускулярными, и волновыми свойствами. При этом он предположил, что частице, свободно движущейся с постоянной скоростью  , соответствует плоская монохроматическая волна
, соответствует плоская монохроматическая волна
 , (4.2)
, (4.2)
где 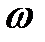 и
и  – ее частота и волновой вектор.
– ее частота и волновой вектор.
Волна (4.2) распространяется в направлении движения частицы ( //
// 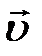 ). Такие волны получили название фазовых волн, волн вещества или волн де Бройля.
). Такие волны получили название фазовых волн, волн вещества или волн де Бройля.
Идея де Бройля заключалась в том, чтобы расширить аналогию между оптикой и механикой, а волновую оптику сопоставить с волновой механикой, пытаясь применить последнюю к внутриатомным явлениям. Попытка приписать электрону, и вообще всем частицам, подобно фотонам, двойственную природу, наделить их волновыми и корпускулярными свойствами, связанными между собой квантом действия, – такая задача представлялась крайне необходимой и плодотворной. ”…Необходимо создать новую механику волнового характера, которая будет относиться к старой механике как волновая оптика к геометрической оптике”, – писал де Бройль в книге «Революция в физике».
Далее необходимо было вывести соотношения, связывающие корпускулярные и волновые свойства частиц. Эти соотношения должны быть релятивистски инвариантными.
Частица массы  , движущаяся со скоростью
, движущаяся со скоростью  , имеет энергию
, имеет энергию
 (4.3)
(4.3)
и импульс
 , (4.4)
, (4.4)
а состояние движения частицы характеризуется четырехмерным вектором энергии-импульса ( ).
).
С другой стороны, в волновой картине мы используем понятие частоты  и волнового числа
и волнового числа  (или длины волны
(или длины волны  ), а соответствующим плоской волне 4-вектором является (
), а соответствующим плоской волне 4-вектором является ( ).
).
Так как оба приведенных описания являются различными аспектами одного и того же физического объекта, то между ними должна существовать однозначная связь; релятивистски инвариантным соотношением между 4-векторами является
 , (4.5)
, (4.5)
или
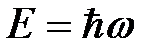 ;
;  . (4.6)
. (4.6)
Выражения (4.6) называют формулами де Бройля. Длина волны де Бройля определяется, таким образом, формулой
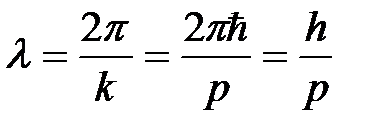 (4.7)
(4.7)
(здесь  ). Именно эта длина волны должна фигурировать в формулах при волновом описании эффекта Рамзауэра – Таунсенда и опытов Дэвиссона – Джермера[4].
). Именно эта длина волны должна фигурировать в формулах при волновом описании эффекта Рамзауэра – Таунсенда и опытов Дэвиссона – Джермера[4].
С учетом (4.6) формулу (4.2) можно записать в виде плоской волны
 , (4.8)
, (4.8)
соответствующей частице, имеющей импульс  и энергию
и энергию  .
.
Волны де Бройля характеризуются фазовой и групповой скоростями. Фазовая скорость определяется из условия постоянства фазы волны (4.8)  и для релятивистской частицы равна
и для релятивистской частицы равна
 , (4.9)
, (4.9)
то есть она всегда больше скорости света[5]. Групповая скорость волн де Бройля равна скорости движения частицы:
 . (4.10)
. (4.10)
Из (4.9) и (4.10) следует связь между фазовой и групповой скоростями волн де Бройля:
 . (4.11)
. (4.11)
Каков же физический смысл волн де Бройля и какова их связь с частицами вещества?
В рамках волнового описания движения частицы значительную гносеологическую сложность представил вопрос о ее пространственной локализации. Волны де Бройля (4.2), (4.8) заполняют все пространство и существуют неограниченное время. Свойства этих волн всегда и везде одинаковы: постоянны их амплитуда и частота, неизменны расстояния между волновыми поверхностями и др. С другой стороны, микрочастицы сохраняют свои корпускулярные свойства, то есть обладают определенной массой, локализованной в определенной области пространства. Для того, чтобы выйти из создавшегося положения, частицы стали представлять не монохроматическими волнами де Бройля, а наборами волн с близкими частотами (волновыми числами) – волновыми пакетами:
 ; (4.12)
; (4.12)