Спиновые квантовые числа и спиновые моменты электрона. Опыты Штерна и Герлаха.
Электрон обладает собственным неуничтожимым механическим моментом импульса - спином. Спин электрона и др. микрочастиц - квантовая величина. Если электронам приписывается собственный механический момент импульса – спин  , то ему соответствует собственный магнитный момент
, то ему соответствует собственный магнитный момент 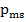 . Спин квантуется по закону
. Спин квантуется по закону

s-спиновое квантовое число.
Вектор  прнимает (2s+1) ориентацию, т.к. в опытах Штерна и Герлаха наблюдаются только 2 ориентации, то 2s+1=2, s=1/2.,
прнимает (2s+1) ориентацию, т.к. в опытах Штерна и Герлаха наблюдаются только 2 ориентации, то 2s+1=2, s=1/2., 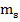 -магнитное спиновое квантовое число
-магнитное спиновое квантовое число  Магнитное спиновое квантовое число
Магнитное спиновое квантовое число 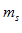 - число, которое определяет проекцию спина на направление внешнего магнитного поля.Целью опытов Штерна и Герлаха являлось изменение магнитных моментов атомов различных элементов. Идея опытов заключалась в измерении силы действующей на атом в неоднородном м.п. Опыты обнаружили ошибочность предположения о том, что магнитный момент
- число, которое определяет проекцию спина на направление внешнего магнитного поля.Целью опытов Штерна и Герлаха являлось изменение магнитных моментов атомов различных элементов. Идея опытов заключалась в измерении силы действующей на атом в неоднородном м.п. Опыты обнаружили ошибочность предположения о том, что магнитный момент  и механический момент импульса L атома произвольно ориентирован относительно напр. внешнего поля и подтвердили наличие пространственного квантования.Проводя прямые измерения магнитных моментов Ш. и Г. обнаружили, что узкий пучок атомов водорода, находящийся в состоянии S в неоднородном м.п. расщепляется на 2 пучка. В этом состоянии момент импульса = 0, и м.п. не должно оказывать влияние на движ. атомов водорода в основном состоянии, т.е расщепления быть не должно. В дальнейшем было доказано, что спектральные лини атома водорода обнаруж. тонкую структуру(явл. дубликатами) даже в отсутсвии м.п.
и механический момент импульса L атома произвольно ориентирован относительно напр. внешнего поля и подтвердили наличие пространственного квантования.Проводя прямые измерения магнитных моментов Ш. и Г. обнаружили, что узкий пучок атомов водорода, находящийся в состоянии S в неоднородном м.п. расщепляется на 2 пучка. В этом состоянии момент импульса = 0, и м.п. не должно оказывать влияние на движ. атомов водорода в основном состоянии, т.е расщепления быть не должно. В дальнейшем было доказано, что спектральные лини атома водорода обнаруж. тонкую структуру(явл. дубликатами) даже в отсутсвии м.п.
10. Главное квантовое число n – число, которое определяет энергетические уровни электрона в атоме и может принимать любые целые значения.. Атом Н и ВДПА – система состоящая из ядра с зарядом ze и одного е. Энергия электрона в атоме водорода: 
Z-поряд ном элем,зарядовое число,Амассовое число
Главное квантовое число n – число, которое определяет энергетические уровни электрона в атоме и может принимать любые целые значения.
Орбитальное квантовое число l – число, которое при заданном n принимает значения 0,1…(n-1), т.е. всего n-значений и определяет момент импульса электрона в атоме.
Магнитное квантовое число 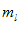 определяет проекцию момента импульса электрона на заданное направление, причём вектор момента импульса электрона в атоме может иметь в пространстве (2l+1) ориентаций.
определяет проекцию момента импульса электрона на заданное направление, причём вектор момента импульса электрона в атоме может иметь в пространстве (2l+1) ориентаций.
Магнитное спиновое квантовое число 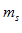 - число, которое определяет проекцию спина на направление внешнего магнитного поля.
- число, которое определяет проекцию спина на направление внешнего магнитного поля.
Орбитальный магнитный момент электрона:  g-гиромаг отнош спиновых мом,Les-спинОрбитальный механический момент электрона
g-гиромаг отнош спиновых мом,Les-спинОрбитальный механический момент электрона 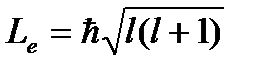 l-орбит квант чис
l-орбит квант чис
12. Принцип Паули: обобщая общие данные Паули сформировал принцип, согласно которому система фермионов (частиц с полуцелым спином) встречается в природе только в состояниях, описываемых антисимметричными волновыми функциями. Принцип Паули помогает объяснить разнообразные физические явления. Следствием принципа является наличиеэлектронных оболочек в структуре атома, из чего, в свою очередь, следует разнообразие химических элементов и их соединений. Количество электронов в отдельном атоме равно количеству протонов. Распред эл по различ квант сост подчин принципу паули соглнасно кот в одном состоянии не может быть 2-х одинак эл(с одинак набором 4-х квантовых чисел)они должны отлич,например напревлением спина
13) Электронная оболочка – совокупность электронов в многоэлектронном атоме имеющих одно и то же главное квантовое число n.В каждой из оболочек электрона распределяются на подоболочки соответствующим данномуl. В многоэлектронных атомах на каждый электрон действует не только ядро, но и все остальные электроны. При этом электронные облака отдельных электронов как бы сливаются в одно общее многоэлектронное облако. Электроны в атоме расположены на энергетических уровнях, которые со- держат различные энергетические подуровни, состоящие, в свою очередь, из определенного количества атомных орбиталей: s- подуровень состоит из одной, р- подуровень ─ из трех, d- подуровень ─ из пяти и f- подуровень ─ из семи орбиталей.
14) Спектр – набор частот или длины волны излучения которое излучает тело. Линейчатый спектр – совокупность отдельных линий, появляющихся на фоне сплошного спектра.
Сплошной - это спектр, содержащий все длины волн определенного диапазона от красного с λ ≈ 7,6.10-7 м до фиолетового с λ ≈ 4.10-7 м. Сплошной спектр излучают нагретые твердые и жидкие вещества, газы, нагретые под большим давлением.Тормозной спектр – это сплошной рентгеновский спектр.
Обобщённая формула Бальмера: 
Больмер подобрал формулу описывающую все известные линии атома водорода в видимой области спектра. ТЕРМЫСПЕКТРАЛЬНЫЕ -уровни энергии атома, иона или молекулы, характеризующиеся определ. значениями полного орбитального момента L и полного спина S электронов.Rштрих постоянная гидберга,R=Rштрх*с
15.16) Спонтанное излучение – процесс испускания фотона возбуждённым атомом без каких-либо внешних воздействий.Вынужденное излучение — излучение атомов фотона дополнительно к тому фотону, под действием которого произошёл переход.Структура энергетических уровней молекул определят их спектр излучения, возникающий при квантовых переходах между соответствующими энергетическими уровнями. Электроны в атоме расположены на энергетических уровнях, которые со- держат различные энергетические подуровни, состоящие, в свою очередь, из определенного количества атомных орбиталей: s- подуровень состоит из одной, р- подуровень ─ из трех, d- подуровень ─ из пяти и f- подуровень ─ из семи орбиталей. При распределении электронов по квантовым ячейкам следует руководство- ваться принципом Паули: в атоме не может быть двух электронов с одинаковым набором значений всех квантовых чисел, т. е. атомная орбиталь не может содер- жать более двух электронов, причем их спиновые моменты должны быть проти-воположными. Состояние с инверсией населенностей – неравномерное состояние системы, при котором число атомов в возбуждённых состояниях было больше, чем их число в искомом состоянии
18. Периодический закон был сформулирован Д. И. Менделеевым в следующем виде (1871): «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса». Заполнение электронами состояний в атомах происходит в порядке возрастания их энергий и понижения полной энергии атомов. При этом выполняется принцип Паули, и каждое состояние может быть занято либо одним, либо двумя электронами. В последнем случае электроны обязательно имеют противоположные спины и называются спаренными Для нейтральных атомов в основном состоянии последовательность заполнения АО следующая: 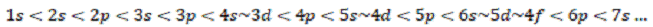
19. Распределение Ферми-Дирака: 
Мю-хим потенц,Т-термодинам темп,к-постоян больц,<Ni>-среднее число бозонов в квант сост с энергией. Распред эл по различ квант сост подчин принципу паули соглнасно кот в одном состоянии не может быть 2-х одинак эл(с одинак набором 4-х квантовых чисел)они должны отлич,например напревлением спина
20.21. Энергия Ферми – это увеличение энергии основного состояния системы при добавлении одной частицы.Уровень Ферми – наивысший энергетический уровень, занятый электронами. ПриТ=0 К
Все нижние квантовые состояния вплоть до сост энергии мю0 замелнены эл,а все сост с энергией >мю0свободны.мю0-как макс кинетич эн,кот могут иметь эл при нуле К,эн ферми=мю0
22. Условия электропроводимости твёрдых тел. Квантовая теория электропроводимости металлов. Квантовая теория электропроводности металлов - теория электропроводности, основывающаяся на квантовой механике и квантовой статистике Ферми - Дирака, - пересмотрела вопрос об электропроводности металлов, рассмотренный в классической физике. Расчет электропроводности металлов, выполненный на основе этой теории, приводит к выражению для удельной электрической проводимости металла. Таким образом, электропроводность (электросопротивление) обусловлена концентрацией электронов проводимости и их подвижностью. Концентрация электронов проводимости от температуры практически не зависит.
 - удельная электрическая проводимость металла
- удельная электрическая проводимость металла
n - концентрация e проводимости в металле<lf> - средняя длина свободного пробега e, имеющего E ферми.<UF> - средняя скорость тёплого движения такого e