Белки. Структура белков.
Белок – это последовательность аминокислот, связанных друг с другом пептидными связями.
Легко представить, что количество аминокислот может быть различно: от минимум двух до любых разумных величин. Биохимики условились считать, что если количество аминокислот не превышает 10, то такое соединение называется пептид; если от 10 и более аминокислот – полипептид. Полипептиды, способные самопроизвольно формировать и удерживать определенную пространственную структуру, которая называется конформацией, относят к белкам. Стабилизация такой структуры возможна лишь при достижении полипептидами определенной длины (более 40 аминокислот), поэтому белками обычно считают полипептиды молекулярной массой более 5 000 Да. (1Да равен 1/12 изотопа углерода). Только имея определенное пространственное строение (нативную структуру), белок может выполнять свои функции.
Размер белка может измеряться в дальтонах (молекулярная масса), чаще из-за относительно большой величины молекулы в производных единицах — килодальтонах (кДа). Белки дрожжей, в среднем, состоят из 466 аминокислот и имеют молекулярную массу 53 кДа. Самый большой из известных в настоящее время белков — титин — является компонентом саркомеров мускулов; молекулярная масса его различных изоформ варьирует в интервале от 3000 до 3700 кДа, он состоит из 38 138 аминокислот (в человеческой мышце solius).
Структура белка
Трехмерная структура белка формируется в процессе фолдинга (от англ. folding - «сворачивание»). Трехмерная структура формируется в результате взаимодействия структур более низких уровней. Выделяют четыре уровня структуры белка:
Первичная структура — последовательность аминокислот в полипептидной цепи.
Вторичная структура — это размещение в пространстве отдельных участков полипептидной цепи. Ниже приведены самые распространенные типы вторичной структуры белков:
α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм (на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 аминокислотных остатка. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина, серина, треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывает изгиб цепи и также нарушают структуру α-спирали.
β-складчатые слои — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удаленными друг от друга (0,347 нм на аминокислотный остаток) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация). Для образования β-складчатых слоев важны небольшие размеры боковых групп аминокислот, обычно преобладают глицин и аланин.
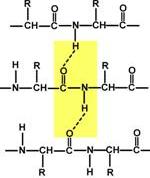 Участие водородных связей в формировании вторичной структуры
Участие водородных связей в формировании вторичной структуры
|  Укладка белка в виде α-спирали
Укладка белка в виде α-спирали
|
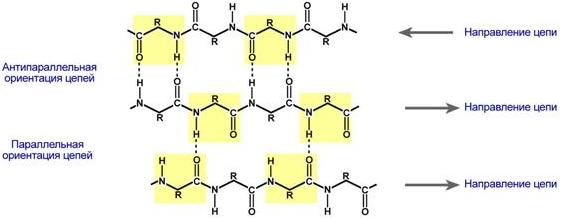
Укладка белка в виде β-складчатого слоя
Неупорядоченные структуры - это неупорядоченное расположение белковой цепи в пространстве.
Пространственная структура каждого белка индивидуальна и определяется его первичной структурой. Однако сравнение конформаций разных по структуре и функциям белков выявило наличие у них похожих сочетаний элементов вторичной структуры. Такой специфический порядок формирования вторичных структур называют супервторичной структурой белков. Супервторичная структура формируется за счёт межрадикальных взаимодействий.
Определённые характерные сочетания α-спиралей и β-структур часто обозначают как "структурные мотивы". Они имеют специфические названия: "α-спираль-поворот-α-спираль", "структура α/β-бочонка", "лейциновая застёжка-молния", "цинковый палец" и др.
Третичная структура – это способ размещения в пространстве всей полипептидной цепи. Наряду с α-спиралями, β-складчатыми слоями и супервторичными структурами в третичной структуре обнаруживается неупорядоченная конформация, которая может занимать значительную часть молекулы.
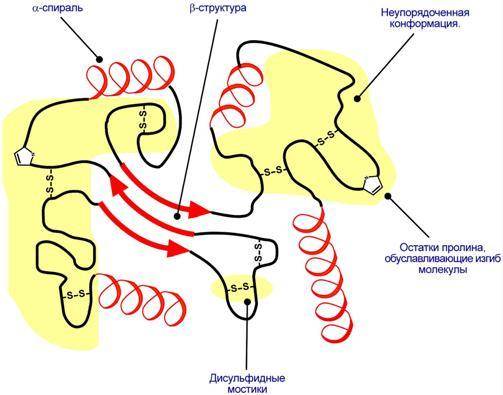
Схематичное представление укладки белка в третичную структуру.
Четвертичная структура возникает у белков, которые состоят из нескольких полипептидных цепей (субъединиц, протомеров или мономеров), при объединении третичных структур этих субъдиниц. Например, молекула гемоглобина состоит из 4 субъединиц. Четвертичную структуру имеют надмолекулярные образования – мультиферментные комплексы, которые состоят из нескольких молекул ферментов и коферментов (пируватдегидрогеназа), и изоферменты (лактатдегидрогеназа - ЛДГ, креатинфосфокиназа –КФК).
Итак. Пространственная структура зависит не от длины полипептидной цепи, а от последовательности аминокислотных остатков, специфичной для каждого белка, а также от боковых радикалов, свойственных соответствующим аминокислотам. Пространственную трехмерную структуру или конформацию белковых макромолекул образуют в первую очередь водородные связи, гидрофобные взаимодействия между неполярными боковыми радикалами аминокислот, ионные взаимодействия между противоположно заряженными боковыми группами аминокислотных остатков. Водородные связи играют огромную роль в формировании и поддержании пространственной структуры белковой макромолекулы. Что касается гидрофобных взаимодействий, то они возникают в результате контакта между неполярными радикалами, неспособными разорвать водородные связи между молекулами воды, которая вытесняется на поверхность белковой глобулы. По мере синтеза белка неполярные химические группировки собираются внутри глобулы, а полярные вытесняются на ее поверхность. Таким образом, белковая молекула может быть нейтральной, заряженной положительно или же отрицательно в зависимости от рН растворителя и ионогенных групп в белке. Кроме того, конформация белков поддерживается ковалентными связями S—S, образующимися между двумя остатками цистеина. В результате образования нативной структуры белка многие атомы, находящиеся на удаленных участках полипептидной цепи, сближаются и, воздействуя друг на друга, приобретают новые свойства, отсутствующие у индивидуальных аминокислот или небольших полипептидов.
Важно понимать, что фолдинг — сворачивание белков (и других биомакромолекул) из развёрнутой конформации в «нативную» форму — физико-химический процесс, в результате которого белки в своей естественной «среде обитания» (растворе, цитоплазме или мембране) приобретают характерные только для них пространственную укладку и функции.
В клетках имеется ряд каталитически неактивных белков, которые тем не менее вносят большой вклад в образование пространственных структур белков. Это так называемые шапероны. Шапероны помогают правильной сборке трехмерной белковой конформации путем образования обратимых нековалентных комплексов с частично свернутой полипептидной цепью, одновременно ингибируя неправильно образованные связи, ведущие к формированию функционально неактивных белковых структур. В перечень функций, свойственных шаперонам, входит защита расплавленных (частично свернутых) глобул от агрегации, а также перенос новосинтезированных белков в различные локусы клеток. Шапероны преимущественно являются белками теплового шока, синтез которых резко усиливается при стрессовом температурном воздействии, поэтому их называют еще hsp (heat shock proteins). Семейства этих белков найдены в микробных, растительных и животных клетках. Классификация шаперонов основана на их молекулярной массе, которая варьирует от 10 до 90 kDa. Они являются белками-помощниками процессов образования трехмерной структуры белков. Шапероны удерживают новосинтезированную полипептидную цепь в развернутом состоянии, не давая ей свернуться в отличную от нативной форму, и обеспечивают условия для единственно правильной, нативной структуры белка.
В процессе фолдинга белка некоторые конформации молекулы забраковываются на стадии расплавленной глобулы. Деградацию таких молекул инициирует белок убиквитин. Деградация белка по убиквитиновому пути включает две основные стадии: 1) ковалентное присоединение убиквитина к подлежащему деградации белку через остаток лизина, наличие такой метки в белке является первичным сигналом сортировки, направляющей образовавшиеся конъюгаты к протеасомам, в большинстве случаев к белку присоединяется несколько молекул убиквитина, которые организованы в виде бусинок на нитке.; 2) гидролиз белка протеосомой (основная функция протеасомы – протеолитическая деградация ненужных и повреждённых белков до коротких пептидов). Убиквитин заслуженно называют «меткой смерти» для белка.
Вообще система убиквитинилирования вовлечена в такие важные процессы, как пролиферация, развитие и дифференцировка клеток, реакция на стресс и патогены, репарация ДНК, поскольку присоединение убиквитина может оказывать различное воздействие на белки-мишени: оно влияет на внутриклеточную локализацию и функцию белков, оказывает воздействие на их активность, способствует или препятствует белок-белковым взаимодействиям. А самым первым открытием как раз стала деградация белков, помеченных мультиубиквитиновыми цепями, с помощью 26S-протеасомы.
Доме́н белка́ – элемент третичной структуры белка, представляющий собой достаточно стабильную и независимую подструктуру белка, чей фолдинг проходит независимо от остальных частей. В состав домена обычно входит несколько элементов вторичной структуры. Сходные по структуре домены встречаются не только в родственных белках (например, в гемоглобинах разных животных), но и в совершенно разных белках. Белок может иметь несколько доменов, эти участки могут выполнять разные функции в одном и том же белке. Доменную структуру имеют некоторые ферменты и все иммуноглобулины. Белки с длинными полипептидными цепями (более 200 аминокислотных остатков) часто создают доменные структуры.
Болезни, связанные с нарушением фолдинга белков
Расчёты показали, что лишь небольшая часть теоретически возможных вариантов полипептидных цепей может принимать одну стабильную пространственную структуру. Большинство же таких белков может принимать множество конформаций с примерно одинаковой энергией Гиббса, но с различными свойствами. Первичная структура большинства известных белков, отобранных эволюцией, обеспечивает исключительную стабильность одной конформаций.
Однако некоторые растворимые в воде белки при изменении условий могут приобретать конформацию плохо растворимых, способных к агрегации молекул, образующих в клетках фибриллярные отложения, именуемые амилоидом (от лат. amylum - крахмал). Так же как и крахмал, амилоидные отложения выявляют при окраске ткани йодом. Это может происходить:
при гиперпродукции некоторых белков, в результате чего увеличивается их концентрация в клетке;
при попадании в клетки или образовании в них белков, способных влиять на конформацию других молекул белка;
при активации протеолиза нормальных белков организма, с образованием нерастворимых, склонных к агрегации фрагментов;
в результате точечных мутаций в структуре белка.
В результате отложения амилоида в органах и тканях нарушаются структура и функция клеток, наблюдают их дегенеративные изменения и разрастание соединительнотканных или глиальных клеток. Развиваются болезни, называемые амилоидозами. Для каждого вида амилоидоза характерен определённый тип амилоида. В настоящее время описано более 15 таких болезней.
Болезнь Альцхаймера - наиболее часто отмечаемый β-амилоидоз нервной системы, как правило, поражающий лиц преклонного возраста и характеризующийся прогрессирующим расстройством памяти и полной деградацией личности. В ткани мозга откладывается β-амилоид - белок, образующий нерастворимые фибриллы, нарушающие структуру и функции нервных клеток. β-амилоид - продукт изменения конформаций нормального белка организма человека. Он образуется из более крупного предшественника частичным протеолизом и синтезируется во многих тканях. β-Амилоид, в отличие от своего нормального предшественника, содержащего много α-спиральных участков, имеет вторичную β-складчатую структуру, агрегирует с образованием нерастворимых фибрилл, устойчив к действию протеолитических ферментов.
Причины нарушения фолдинга нативных белков в ткани мозга ещё предстоит выяснить. Возможно, с возрастом уменьшается синтез шаперонов, способных участвовать в формировании и поддержании нативной конформаций белков, или увеличивается активность протеаз, что приводит к увеличению концентрации белков, склонных изменять конформацию.
Прионовые болезни
Прионы - особый класс белков, обладающих инфекционными свойствами. Попадая в организм человека или спонтанно возникая в нём, они способны вызывать тяжёлые неизлечимые заболевания ЦНС, называемые прионовыми болезнями. Название "прионы" происходит от аббревиатуры английской фразы proteinaceous infectious particle - белковая инфекционная частица.
Прионовый белок кодируется тем же геном, что и его нормальный аналог, т.е. они имеют идентичную первичную структуру. Однако два белка обладают различной конформацией: прионовый белок характеризуется высоким содержанием β-слоёв, в то время как нормальный белок имеет много α-спиральных участков. Кроме того, прионовый белок обладает устойчивостью к действию протеаз и, попадая в ткань мозга или образуясь там спонтанно, способствует превращению нормального белка в прионовый в результате межбелковых взаимодействий. Образуется так называемое "ядро полимеризации", состоящее из агрегированных прионовых белков, к которому способны присоединяться новые молекулы нормального белка. В результате в их пространственной структуре происходят конформационные перестройки, характерные для прионовых белков. Поражённые ткани выглядят как губка, поэтому эти болезни называются губчатыми энцефалопатиями. Обычными симптомами таких заболеваний являются губчатое поражение мозга, слабоумие, бессонница, эпилептические припадки и летальный исход.
Известны случаи наследственных форм прионовых болезней, вызванных мутациями в структуре данного белка. Однако возможно и заражение человека прионовыми белками, в результате чего возникает заболевание, приводящее к гибели больного. Так, куру - прионовая болезнь аборигенов Новой Гвинеи, эпидемический характер которой связан с традиционным каннибализмом в этих племенах и передачей инфекционного белка от одной особи к другой. В связи с изменением образа их жизни данное заболевание практически исчезло.
В настоящее время интерес к прионовым болезням возрос в связи с заражением людей прионами при употреблении мясопродуктов, полученных от животных, являющихся носителями прионов, вызывающих "бешенство коров" (болезнь Кройтцфельдта-Якоба). Несмотря на то, что прионовые белки человека и животных различаются лишь незначительно, долгое время полагали, что существуют межвидовые барьеры на пути передачи болезни. Однако последние данные показали, что эти барьеры не абсолютны, и что существует принципиальная возможность передачи болезни от одного вида другому. Так, в Великобритании к середине 1999 г. было зарегистрировано около 40 случаев данного заболевания. Прогноз не исключает развития эпидемии прионовой болезни в ближайшие 10-15 лет.
Несколько примеров болезней в результате нарушения фолдинга белков:
Прионовые заболевания (у людей – куру («смеющаяся смерть»), болезнь Крейцфельда-Якоба, синдром Герштмана-Штресслера-Шейнкера, семейная фатальная бессонница; у коров, норок, оленей, коз – бешенство (губчатая энцефалопатия), у овец – почесуха (scrappy)).
Болезнь Альцгеймера
Болезнь Хантингтона