Тема. Металлы.
1) Особенности строения атомов и кристаллов.
Более 200 лет назад М.В. Ломоносов в труде «Первые основы металлургии» дал металлам такое определение: «Металлы – суть ковкие блестящие тела».
Для того времени эта краткая формулировка была достаточно верной. В конце урока мы возвратимся к этому определению и сделаем вывод: согласиться с этим определением или дополнить его.
Вы уже познакомились с Периодической системой химических элементов Д.И. Менделеева, с классификацией химических элементов и узнали, что из 109 известных в настоящее время элементов более 80 являются металлами. Термин «металлы» относится и к химическим элементам, и к простым веществам.
2) Физические свойства металлов.
¾ Агрегатное состояние: кроме ртути, все металлы твердые.
¾ Электро- и теплопроводны
Ag, Cu, Au, Al, Zn, Fe, Pb, Mg, Hg →
Электро- и теплопроводность уменьшается
¾ Твердость различна.
Cr, W, Ni, Pt, Fe, Cu, Al, Ag, Zn, Au, Ca, Mg, Sn, Pb, K, Na →
Твёрдость уменьшается
¾ Плотность различна.
Os, Pt, Au, Hg, Pb, Ag, Cu, Ni, Fe, Sn, Zn, Al, Mg, Ca, Na, K, Li →
Плотность уменьшается.
¾ Температуры плавления и кипения различны.
W (3420), Pt (1772), Fe, Ni, Cu, Au, Ag, Ca, Al, Mg, Zn, Pb, Sn, Na, K (63,5), Ga (29,7), Cs (28,5),Hg (-39).
¾ Ковкость, пластичность, прочность:
пластичные – Au, Ag, Cu.
хрупкие – Cr, Mn.
¾ Способность намагничиваться: Fe, Co, Ni;
слабо – Al, Cr, Ti;
не притягиваются – Sn, Cu, Bi.
Окрашивание пламени катионами металлов
¾ Li+,Sr2+ – карминово-красный цвет.
¾ K+, Rb+, Cs+ – фиолетовый.
¾ Na+ – ярко-желтый.
¾ Ca2+ – кирпично-красный.
¾ Ba2+ – желто-зеленый.
¾ Cu2+ – зеленый
¾ Pb2+ – голубой.
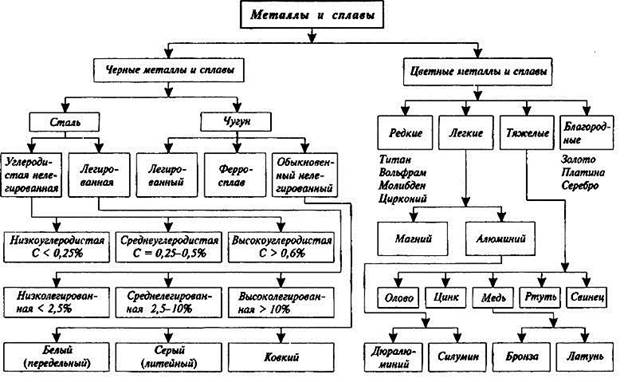
3) Классификация металлов по различным признакам.
Как ни странно, но единой классификации металлов не существует и тому есть ряд причин. Один из привычных видов классификации, заключается в разделении материалов следующим образом:
Черные металлы;
Стали;
Чугуны;
Цветные металлы и сплавы;
Благородные металлы;
Редкие цветные металлы;
Легкие цветные металлы;
Тяжелые цветные металлы.
Существует также классификация металлов следующего содержания:
· по основному компоненту (железные, алюминиевые, медные, магниевые, титановые и другие);
· по числу содержащихся компонентов (двух, трех и многокомпонентные. по технологии изготовления);
· по плотности (легкие, тяжелые, высокоплотные);
· по температуре плавления (легкоплавкие, тугоплавкие).
Еще один вариант классификации металлов – легкие металлы, тяжелые цветные металлы, благородные металлы, тугоплавкие, рассеянные, радиоактивные и редкоземельные.
4) Химические свойства металлов. Электрохимический ряд напряжений металлов.
Металлы взаимодействуют:
1. с неметаллами → бинарные соединения;
2. с водой. Щелочные и щелочноземельные металлы → щелочь + водород; некоторые активные металлы (до водорода) при нагревании → оксид металла + водород;
3. с растворами кислот (кроме азотной): Металлы до водорода → соль + водород;
4. с растворами солей – вытесняют металлы из раствора соли только металлы после магния;
5. с растворами щелочей – переходные металлы → соль + водород.
5) Металлотермия.
МЕТАЛЛОТЕРМИЯпроцессы получения металлов, основанные на восстановлении их оксидов и галогенидов другими, болееактивными металлами; протекают с выделением тепла. С помощью М. получают такие металлы, как, напр.,Ti, U, РЗЭ, Nb, Та, безуглеродистые сплавы, отличающиеся высокой чистотой (гл. обр. по углероду). Высокаячистота конечных продуктов металлотермич. восстановления обусловливает, напр., высокую пластичностьполученных металлов, т. к. содержание мн. примесей в них, в первую очередь примесей внедрения, наочень низком уровне.
Металлотермич. процессы инициируются теплом. Исходным соед. для М. в осн. служат оксиды, хлориды ифториды. Хлориды и фториды обычно используют в тех случаях, когда содержание кислорода в получаемомметалле (напр., Ti) должно быть ограничено либо разделение металлич. и шлаковой оксидной фаззатруднено из-за высокой хим. активности восстановленных металлов (РЗЭ). Осн. требования к исходномусоед. высокое тепловыделение при восстановлении, простота и полнота отделения исходного соед. отполучаемого металла.
Металлотермическими реакциями называют реакции получения металлов из их оксидов, сульфидов и других соединений за счет взаимодействия этих соединений с металлами-восстановителями при высоких температурах. Этот метод, открытый в 1856 г. Н.Н. Бекетовым, нашел применение, как в промышленности, так и для лабораторного получения металлов, сплавов и некоторых неметаллов. Возможность данного метода определяется физико-химическими свойствами исходных и получаемых веществ и тепловыми условиями проведения реакций.
При комнатной температуре такие реакции практически не протекают, но и при нагревании скорость реакции возрастает слишком незначительно. Только при температуре плавления хотя бы одного из компонентов (чаще всего металла – восстановителя) процесс идет со значительной скоростью. Для осуществления металлотермической реакции порошкообразную смесь оксида и восстановителя нагревают до расплавления одного из компонентов. Если компоненты реакционной смеси могут быть расплавлены за счет тепла, выделяющегося при протекании реакции восстановления, для инициирования реакции используют зажигательные смеси.