СОДЕРЖАНИЕ
Общие указания по выполнению контрольной работы
Термодинамические процессы
Термодинамические циклы
Водяной пар
Расчёт теплообменных аппаратов
Библиографический список
ОБЩИЕ УКАЗАНИЯ ПО ВЫПОЛНЕНИЮ КОНТРОЛЬНОЙ РАБОТЫ
ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ
Контрольная работа выполняется студентом после изучения программы всего курса. Решение задач осуществляется по индивидуальному заданию, включающему 4 задачи и 4 контрольных вопроса.
Самостоятельное выполнение контрольной работы закрепляет и углубляет знания и вырабатывает умение применять теоретический материал для решения конкретных практических теплотехнических вопросов.
По качеству выполнения контрольной работы и ее защите оценивается уровень подготовки студента.
При выполнении контрольной работы необходимо:
1. Записать условия задачи.
2. Записать, что дано, и что требуется определить.
3. Решение необходимо сопровождать кратким пояснительным текстом.
4. Записывать формулы и давать пояснения величинам.
5. В формулы подставлять заданные значения величин и приводить результаты вычислений.
6. Обязательно проставлять в системе СИ размерности величин, полученных в расчетах.
7. Графический материал должен быть выполнен четко в масштабе.
8. После решения каждой задачи должны быть сделаны краткие выводы.
Ниже приводятся краткие теоретические предпосылки для выполнения заданий и методика решения типовых задач, сопровождаемая числовыми примерами.
ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ
 Изменение состояния термодинамической системы вследствие воздействия на неё внешней среды называется термодинамическим процессом. При этом происходит последовательное изменение параметров рабочего тела.
Изменение состояния термодинамической системы вследствие воздействия на неё внешней среды называется термодинамическим процессом. При этом происходит последовательное изменение параметров рабочего тела.
Так при перемещении поршня в цилиндре объём, а с ним давление и температура находящегося внутри газа будут изменяться, будет совершаться процесс расширения или сжатия.
Процессы, под которыми понимают непрерывную последовательность равновесных состояний, через которые проходит рассматриваемая система при изменении своего состояния, называются равновесными. Термодинамический процесс, который может протекать через одни и те же равновесные состояния как в прямом 1-2. так и в обратном 2-1 направлениях, называется обратимым (рис. 1). При этом не происходит остаточных изменений ни в самой системе, ни в окружающей среде. Равновесные процессы - являются обратимыми.
Любой реальный процесс в той или иной степени неравновесный. В термодинамике в отдельных случаях процессы идеализируют путём допущений. Идеализация процессов упрощает термодинамические исследования. Такой процесс является образцом, к которому следует стремиться на практике.
Термодинамические процессы математически выражаются уравнениями, связывающими между собой основные термодинамические параметры состояния рабочего тела f(P,v,T)=0. В зависимости от характера и условий протекания процесса математическое выражение первого закона термодинамики q=Δu+l приобретает то или иное частное значение.
Параметры состояния рабочего тела находятся в функциональной зависимости:
Р =f(Т, v); Т =f(Р, v); v =f(Р, Т).
Если хотя бы один из параметров состояния меняется, то изменяется состояние самой системы, т.е. происходит термодинамический процесс. Практический интерес представляют частные термодинамические процессы: изохорный (dv= 0), протекающий при постоянном объёме; изобарный (dр =0) - при постоянном давлении; изотермический (dТ = 0) - при постоянной температуре; адиабатный (dq=0 ), протекающий без теплообмена с окружающей средой. Обобщающим процессом, охватывающим всю совокупность основных термодинамических процессов, является политропный процесс.
Для анализа термодинамических процессов широко используется система координат Т-s. Параметр s называется энтропия. Изменение энтропии является мерой необратимости реального процесса в замкнутой системе.
Задача анализа термодинамического процесса заключается в установлении закономерностей изменения параметров состояния рабочего тела и особенностей превращения энергии в данном процессе.
Изохорный процесс определяется условием dv=0. Уравнение процесса принимает вид v = сопst. Графики процесса представлены на рис. 2. Из уравнения состояния Pv=RT следует, что
R/v =р/Т= const,
т.е. давление идеального газа прямо пропорционально его абсолютной температуре. Так как dv=0, то работа расширения (сжатия) в данном процессе не совершается, а вся подведённая (отведенная) теплота, согласно первому закону термодинамики, расходуется на изменение внутренней энергии тела:
dq=du.
Изобарный процесс характеризуется постоянным значением давления, dp=0. Уравнение процесса имеет вид p=const. Графики процесса представлены на рис. 2. Из уравнения состояния идеального газа получим:
v/Т = R/р = сопst,
т.е. объём идеального газа прямо пропорционален его абсолютной температуре. Подведённая (отведенная) теплота, расходуется как на изменение внутренней энергии тела, так и на совершение работы:
dq=du+dl.
Изотермический процесс протекает при постоянной температуре, dT=0. Уравнение процесса – T=const (pv=const) ,. Графики процесса представлены на рис. 2. Из уравнения состояния следует, что
p1/p2=v2/v1,
т.е. объём и давление идеального газа обратно пропорциональны. Так как температура постоянна, то изменение внутренней энергии равно нулю Δи = 0. Первый закон термодинамики примет вид:
dq=dl.
Поэтому вся подведённая к рабочему телу теплота расходуется на совершение работы.
Адиабатный процесс - это процесс, протекающий без теплообмена с окружающей средой: dq=0. Уравнение процесса pvk=const, где k - показатель адиабаты (для одноатомных газов k = 1,67; двухатомных k = 1,41; трех- и более k = 1,33). Поскольку k>1, то на графике в координатах v-Р линия адиабаты идет круче изотермы.
 Согласно первому закону термодинамики работа в адиабатном процессе совершается за счет изменения внутренней энергии рабочего тела:
Согласно первому закону термодинамики работа в адиабатном процессе совершается за счет изменения внутренней энергии рабочего тела:
dl=-du.
Политропный процесс описывается уравнением рvп = сопst. Показатель политропы п может принимать любое численное значение в пределах от -∞ до +∞, но для данного процесса он является величиной постоянной.
Политропный процесс имеет обобщающее значение, так-так охватывает всю совокупность основных термодинамических процессов. Не трудно убедиться, что
при п = 0, pvn = сопst и р = со st ( (изобарный процесс);
при п = 1, pvn = сопst и pv = сопst ( T - сопst изотермический процесс);
при п = k, pvn = сопst и pvk = сопst (адиабатный процесс);
при n = ±∞, pvn = сопst и v = сопst (изохорный процесс).
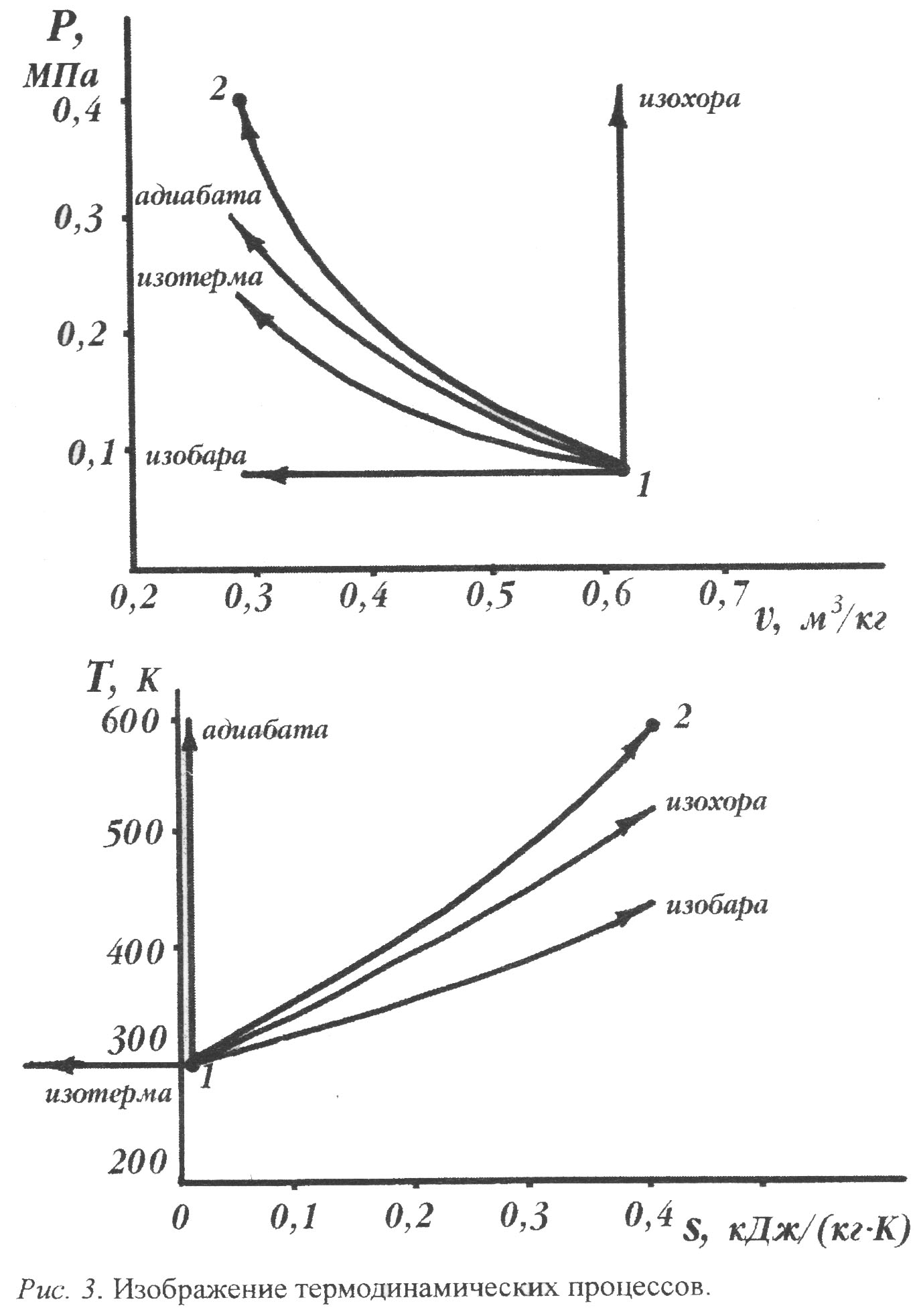
На рис. 2 показано взаимное расположение графиков термодинамических процессов с разными значениями показателя политропы в координатах P-v и Т-s. Все процессы начинаются в одной точке.
Изохора ( n = ±∞ ) делит поле диаграммы на две области: процессы, находящиеся правее изохоры, характеризуются положительной работой, так как сопровождаются расширением рабочего тела: для процессов, расположенных левее изохоры, характерна отрицательная работа.
Процессы, расположенные правее ивыше адиабаты, идут с подводом теплоты к рабочему телу; процессы, лежащие левее и ниже адиабаты, протекают с отводом теплоты.
Для процессов, расположенных над изотермой (п = 1). характерно увеличение внутренней энергии газа; процессы, расположенные под изотермой, сопровождаются уменьшением внутренней энергии.
Процессы, расположенные между адиабатой и изотермой, имеют отрицательную теплоемкость, так как dq и du (а, следовательно, и dT ) имеют в этой области противоположные знаки. В таких процессах |l|>|q|, поэтому на совершение работы при расширении тратится не только подводимая теплота, но ичасть внутренней энергии рабочего тела.
Задача 1
Для ее решения необходимо изучить разделы по газовым законам, теплоемкости газов, первому и второму законам термодинамики, газовым процессам и энтропии.
Условия задачи:
В процессе изменения состояния 1 кг газа внутренняя энергия его увеличивается на  U. При этом над газом совершается работа, равная l. Начальная температура газа t1 конечное давление Р2.
U. При этом над газом совершается работа, равная l. Начальная температура газа t1 конечное давление Р2.
Определить для заданного газа показатель политропы n, начальные и конечные параметры, изменение энтропии  s и изменение энтальпии
s и изменение энтальпии  i (
i ( h). Представить процесс в v-P и s-T координатах. Изобразить здесь же (без расчета) изобарный, изохорный, изотермический и адиабатный процессы, проходящие через начальную точку, и дать их сравнительный анализ.
h). Представить процесс в v-P и s-T координатах. Изобразить здесь же (без расчета) изобарный, изохорный, изотермический и адиабатный процессы, проходящие через начальную точку, и дать их сравнительный анализ.
Дано: Определить:
 U = -143,5 кДж/кг; n; P1; v1;
U = -143,5 кДж/кг; n; P1; v1;
l =-63 кДж/кг; t2; v2;
t1 = 27° С;  s;
s;  i
i
Р2 = 4∙105 Па;
Углекислый газ (СО2).
Решение:
Конечная температура процесса определяется из выражения для изменения внутренней энергии:
 ,
,
где СV - удельная массовая теплоемкость в процессе постоянного объема, вычисляемая из соотношения:

где значения удельной киломольной теплоемкости 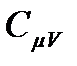 находятся в табл. 2, а молекулярной массы в табл. 1
находятся в табл. 2, а молекулярной массы в табл. 1
Таблица 1
Молекулярные массы газов, кг/кмоль
| Наименование газов | Формула | Молекулярная масса |
| Воздух | - | 28,97 |
| Углекислый газ | СО2 | 44,01 |
| Кислород | О2 | 32,0 |
| Азот | N2 | 28,016 |
| Метан | СН4 | 16,043 |
| Гелий | Не | 4,003 |
| Водород | Н2 | 2,016 |
| Окись углерода | СО | 28,01 |
| Водяной пар | Н2О | 18,016 |
| Аммиак | NН4 | 17,032 |
| Сернистый газ | SO2 | 64,06 |
Таблица 2
Средние теплоемкости газов, кДж/(кмоль К)
| Газы | 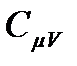
| 
|
| Одноатомные | 12,56 | 20,93 |
| Двухатомные | 20,93 | 29,31 |
| Трех и многоатомные | 29,31 | 37,68 |
Показатель политропы определяется из выражения для работы процесса:

где T1=t1 + 273 = 27 + 273 = 300 К; T2 = t2 + 273 = -188,5 + 273 = 84,5 К;
R - индивидуальная газовая постоянная, определяемая выражением:

Здесь 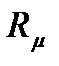 = 8314 Дж/(кмоль К) - универсальная газовая постоянная.
= 8314 Дж/(кмоль К) - универсальная газовая постоянная.
Если l =0, то  - процесс изохорный.
- процесс изохорный.

Для изохорного процесса:
Начальное давление газа можно найти из соотношения параметров политропного процесса:

Для изотермического процесса: 
Начальный и конечный объем определяются из характеристического уравнения состояния газа:

Изменение энтропии составит:

где R - индивидуальная газовая постоянная, кДж/(кг К);
k - показатель адиабаты, определяемый зависимостью:

 ,
, 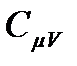 - определяются из табл. 1.
- определяются из табл. 1.
Изменение энтальпии в процессе равно:

Для построения процессов в координатах s - Т (рис. 3) следует вычислить значение энтропии газа в начальном состоянии по формуле:

Контрольный вопрос.
Какова общая формулировка и математическое выражение первого закона термодинамики?
ТЕРМОДИНАМИЧЕСКИЕ ЦИКЛЫ
 Для осуществления непрерывно действующей тепловой машины не один из термодинамических процессов в отдельности не может быть использован, несмотря на его термодинамические преимущества. Все процессы требуют непрерывного движения поршня в одном направлении. В реальных машинах требуется постоянное повторение рабочим телом процесса расширения, т.е. возвращение тела после расширения в начальное состояние, что может быть выполнено при помощи процесса сжатия.
Для осуществления непрерывно действующей тепловой машины не один из термодинамических процессов в отдельности не может быть использован, несмотря на его термодинамические преимущества. Все процессы требуют непрерывного движения поршня в одном направлении. В реальных машинах требуется постоянное повторение рабочим телом процесса расширения, т.е. возвращение тела после расширения в начальное состояние, что может быть выполнено при помощи процесса сжатия.
Таким образом, в непрерывно действующей тепловой машине в дополнение к процессу расширения необходимо осуществить обратный процесс - процесс сжатия, в результате которого рабочее тело будет возвращено в начальное работоспособное состояние. Такой замкнутый процесс называется круговым процессом или циклом.
Для превращения тепловой энергии в механическую работу тепловые двигатели должны иметь горячий источник теплоты, рабочее тело, совершающее замкнутый круговой процесс - цикл, и холодный источник теплоты (рис. 4). Горячим источником служит химическая реакция - сжигания топлива, а в качестве холодного источника используется окружающая среда - атмосфера.
 На рис. 5 площадь фигуры АВСЕFА эквивалентна работе расширения, площадь фигуры СЕFАDС - работе сжатия. В результате каждый килограмм рабочего тела совершает за цикл полезную работу lц, эквивалентную площади АВСD, ограниченной контуром цикла. Теплота, полезно используемая в цикле, равна разности подведенной и отведенной теплоты и эквивалентна площади abcd (рис. 5).
На рис. 5 площадь фигуры АВСЕFА эквивалентна работе расширения, площадь фигуры СЕFАDС - работе сжатия. В результате каждый килограмм рабочего тела совершает за цикл полезную работу lц, эквивалентную площади АВСD, ограниченной контуром цикла. Теплота, полезно используемая в цикле, равна разности подведенной и отведенной теплоты и эквивалентна площади abcd (рис. 5).
Совершенство прямого цикла оценивается термическим коэффициентом полезного действия и определяется отношением работы цикла к количеству теплоты, подведённому к рабочему телу от горячего источника.

Техническая термодинамика рассматривает процессы и наивыгоднейшее их комбинирование, при которых должен был бы работать двигатель внутреннего сгорания (ДВС) в идеальных условиях, чтобы дать наибольший рабочий эффект. При рассмотрении идеальных циклов исследуют процессы, происходящие в цилиндре ДВС, и оценивают факторы, влияющие на термический к.п.д. Изучение идеальных циклов ДВС имеет большое практическое значение, так как дает возможность при помощи опытных данных перенести результаты изучения их на действительные рабочие процессы машин.
В зависимости от способа подведения теплоты различают три термодинамических цикла двигателей внутреннего сгорания:
- с подводом теплоты при постоянном объёме (v = const )- цикл Отто. Цикл характерен для двигателей с внешним смесеобразованием (карбюраторные бензиновые и газовые двигатели);
- с подводом теплоты при постоянном давлении ( p = const ) - цикл Дизеля. По данному циклу работают компрессорные дизельные двигатели, в которых топливо в цилиндрах распыляется сжатым воздухом;
- со смешанным подводом теплоты, т.е. с подводом теплоты как при постоянном объёме, так и при постоянном давлении (v = const и p = const ) - цикл Тринклера. Цикл характерен для бескомпрессорных дизелей с распылением топлива в цилиндрах от механического сжатия.
Два последних цикла характерны для двигателей с внутренним смесеобразованием.

 Цикл Отто состоит из двух изохор и двух адиабат (рис. 6). Имея начальное давление р1 и объём v1; (положение поршня 1), горючая смесь подвергается в цилиндре адиабатному сжатию (линия 1 - 2)до объема v2 (положение поршня II), вследствие чего его давление возрастает до р2. Далее при постоянном объёме, обусловленном остановкой поршня в верхней мертвой точке, (линия 2 - 3) к горючей смеси подводится некоторое количество тепла q1 (горение), вследствие чего его давление возрастает до р3. Постоянство объёма объясняется практически мгновенной скоростью сгорания топлива, находящегося в составе горючей смеси в цилиндре двигателя. После этого газ (продукты горения) адиабатно расширяется до объема v4 = v1 (положение поршня 1). От газа в изохорном процессе (линия 4-1)отводится в холодильник тепло q2 (происходит мгновенное падение давления продуктов горения с р4 до р1; при открытом выпускном клапане) и рабочее тело приходит в первоначальное состояние (точка 1). Процесс падения давления в цилиндре вследствие выхлопа продуктов сгорания в атмосферу условно принимается за изохорный процесс 4-1, так как работа при выхлопе равна нулю.
Цикл Отто состоит из двух изохор и двух адиабат (рис. 6). Имея начальное давление р1 и объём v1; (положение поршня 1), горючая смесь подвергается в цилиндре адиабатному сжатию (линия 1 - 2)до объема v2 (положение поршня II), вследствие чего его давление возрастает до р2. Далее при постоянном объёме, обусловленном остановкой поршня в верхней мертвой точке, (линия 2 - 3) к горючей смеси подводится некоторое количество тепла q1 (горение), вследствие чего его давление возрастает до р3. Постоянство объёма объясняется практически мгновенной скоростью сгорания топлива, находящегося в составе горючей смеси в цилиндре двигателя. После этого газ (продукты горения) адиабатно расширяется до объема v4 = v1 (положение поршня 1). От газа в изохорном процессе (линия 4-1)отводится в холодильник тепло q2 (происходит мгновенное падение давления продуктов горения с р4 до р1; при открытом выпускном клапане) и рабочее тело приходит в первоначальное состояние (точка 1). Процесс падения давления в цилиндре вследствие выхлопа продуктов сгорания в атмосферу условно принимается за изохорный процесс 4-1, так как работа при выхлопе равна нулю.
Процессы впуска и выпуска, осуществляемые при изменяющемся количестве газа и не являющиеся термодинамическими, в цикл не входят.
Основное отличие цикла Дизеля (рис. 7) заключается в том, что подача топлива в цилиндр и, соответственно, его сгорание растянуто во времени. А так как в результате пневматического распыления в цилиндр поступает практически готовая горючая смесь, воспламеняется мгновенно и горит по мере поступления, то рост давления компенсируется увеличением объёма цилиндра в результате движения поршня в нижнюю мертвую точку. В итоге подвод теплоты происходит при постоянном давлении.
Цикл Тринклера (рис.8) предусматривает механический распыл топлива при поступлении его в цилиндр через форсунку. Это приводит к задержке воспламенения, во время которой
 происходит смесеобразование. К моменту воспламенения горючей смеси в цилиндре накапливается некоторое количество топлива и его сгорание происходит в условиях постоянного объёма, как и в карбюраторном двигателе. Но так как подача топлива растянута во времени, горение продолжается при движении поршня на такте расширения и давление в цилиндре при этом, как и в цикле Дизеля, остаётся постоянным.
происходит смесеобразование. К моменту воспламенения горючей смеси в цилиндре накапливается некоторое количество топлива и его сгорание происходит в условиях постоянного объёма, как и в карбюраторном двигателе. Но так как подача топлива растянута во времени, горение продолжается при движении поршня на такте расширения и давление в цилиндре при этом, как и в цикле Дизеля, остаётся постоянным.
Процессы сжатия, расширения и отвода теплоты во всех трёх циклах одинаковы.
 Циклы ДВС характеризуются параметрами цикла: степенью сжатия ε, степенью повышения давления λ и степенью предварительного расширения ρ.
Циклы ДВС характеризуются параметрами цикла: степенью сжатия ε, степенью повышения давления λ и степенью предварительного расширения ρ.
Совершенство цикла оценивается термическим к.п.д.
Цикл со смешанным подводом теплоты при практическом применении имеет несколько больший термический к.п.д. и находит широкое применение в современных двигателях внутреннего сгорания с воспламенением от сжатия.
Задача 2
Для решения этой задачи необходимо использовать теоретический материал по газовым процессам, по теплоемкости и энтропии газов, а также первый и второй законы термодинамики.
Условия задачи:
Определить параметры рабочего тела в характерных точках идеального цикла поршневого двигателя внутреннего сгорания с изохорно-изобарным подводом, теплоты (смешанный цикл), если известны давление Р1 и температура t1 рабочего тела в начале сжатия. Степень сжатия  , степень повышения давления
, степень повышения давления  , степень предварительного расширения
, степень предварительного расширения  - заданы.
- заданы.
Определить работу, получаемую от цикла, его термический КПД и изменение энтропии отдельных процессов цикла. За рабочее тело принять воздух, считая теплоемкость его в расчетных интервалах температур постоянной, построить на миллиметровой бумаге в масштабе этот цикл в координатах v-P и s-Т. Дать к полученным графикам соответствующие пояснения.
Дано: Определить:
Р1 = 0,09 МПа; v1, v2, v3, v4, v5, P2, P3, P4, P5, T2, T3, T4, T5,
t1 = 40° С; l,  ,
,
 = 17; s2-s1, s3-s2,
= 17; s2-s1, s3-s2,
 = 1,6; s4-s3, s5-s4,
= 1,6; s4-s3, s5-s4,
 - 1,2. s1-s5.
- 1,2. s1-s5.
Решение:
Удельный объем воздуха при начальном состоянии находится из характеристического уравнения:

где R = 287 Дж/кг∙К - газовая постоянная воздуха.
Так как сжатие происходит по адиабатному процессу (рис.6-8) то параметры состояния рабочего тела в точке 2 цикла определятся выражениями:

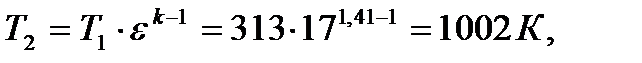
где k - показатель адиабаты, для воздуха равен 1,41.

В процессе 2-3 цикла осуществляется изохорический подвод теплоты в количестве  . Исходя из этого, параметры рабочего тела в точке 3 будут иметь следующие значения:
. Исходя из этого, параметры рабочего тела в точке 3 будут иметь следующие значения:
v3 = v2 = 0,0588 м3/кг;
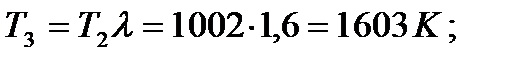
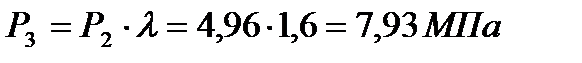
Линия 3-4 на диаграмме изображает изобарический процесс подвода теплоты в количестве  .
.
Исходя из изобарического процесса, параметры в точке 4 составят:
Р4 = Р3 = 7,93 МПа;
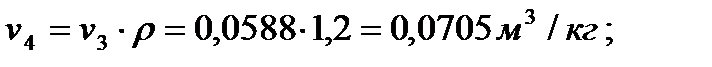
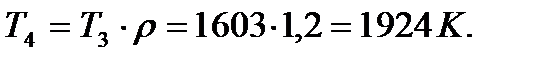
Дальнейший процесс расширения происходит по адиабате 4-5. Параметры состояния рабочего тела в точке 5 определяются выражениями:
v5 = v1 = 1,0 м3/кг;


Количество подведенной теплоты в цикле составит:
 ,
,
где Сv = 0,713 кДж/(кг∙K) и Ср = 1,0 кДж/(кг∙К) - соответственно удельные массовые теплоемкости воздуха в процессах постоянного объема и давления.
Отведенная теплота цикла (процесс 5-1) равна:
q2=Cv (T5-T1) = 0,713 (648-313) = 239 кДж/кг.
Полезная работа цикла составит:
l = q1 – q2 = 750-239 = 511 кДж/кг.
Термический КПД цикла равен:
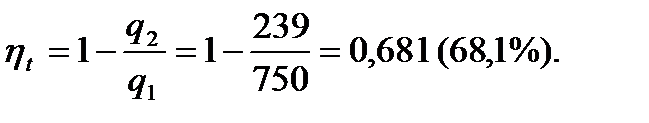
Изменение энтропии в процессах цикла определяется по формуле

Адиабатные процессы 1-2 и 4-5:
s2-s1 = s5-s4 = 0.
Изохорический процесс 2-3:

Изобарический процесс 3-4:

Изохорический процесс 5-1:

Проверка:
Для цикла должно быть:
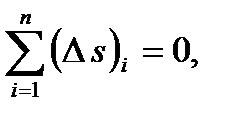
где n - число участков в цикле.
(s2-s1)+(s3-s2)+(s4-s3)+(s5-s4)+(s1-s5)= 0+0,335+0,183+0-0,518=0 - вычисления выполнены правильно.
По результатам вычислений строится в масштабе диаграмма цикла в координатах v-Р и s-Т (рис.9).
Для построения цикла в координатах s-Т следует вычислить значение энтропии газа в начальном состоянии по формуле:

Примечание:
Если в условиях задачи степень предварительного расширения  =1,0, то цикл ДВС осуществляется с подводом теплоты при постоянном объеме, диаграмма которого изображена на рис.6.
=1,0, то цикл ДВС осуществляется с подводом теплоты при постоянном объеме, диаграмма которого изображена на рис.6.
При условии, что степень повышения давления  =1,0, цикл ДВС осуществляется с подводом теплоты при постоянном давлении, диаграмма которого приведена на рис. 7.
=1,0, цикл ДВС осуществляется с подводом теплоты при постоянном давлении, диаграмма которого приведена на рис. 7.
Контрольный вопрос:
После решения задачи дать пояснения по полученным графикам и привести основные формулировки второго закона термодинамики.

ВОДЯНОЙПАР
Водяной пар широко используется во многих отраслях техники и, прежде всего, в теплоэнергетике. Это реальный газ, который является основным рабочим телом в паросиловых установках. На производстве водяной пар получают в котельных установках в условиях постоянного давления.
Процесс парообразования условно делят на три стадии: нагрев воды до температуры кипения, превращение воды в пар в результате кипения, перегрев пара.
При подводе теплоты к воде её температура постепенно повышается, пока не достигнет температуры кипения при данном давлении. При этом удельный объём жидкости сначала уменьшается (при нагреве от 0°С до 4°С), а затем возрастает. При дальнейшем подводе теплоты начинается кипение воды с сильным увеличением объёма. Образуется двухфазная среда - смесь воды и пара, называемая влажным насыщенным паром. По мере подвода теплоты количество жидкой фазы уменьшается, а паровой - растет. Температура смеси при этом остается неизменной, так как вся теплота расходуется на испарение жидкой фазы. Процесс является одновременно и изобарным, и изотермическим. После полного испарения жидкой фазы пар становится сухим насыщенным, его температура остается равной температуре насыщения (кипения) при данном давлении. При сообщении сухому насыщенному пару теплоты его температура будет увеличиваться, а пар станет 
перегретым.
Водяной пар - это реальный газ, и его свойства отличаются от свойств идеального газа. Поэтому на практике при проведении теплотехнических расчетов пользуются диаграммой водяного пара в координатах i - s, фрагмент которой представлен на рис. 10.
Общий метод расчёта по диаграмме состоит в следующем: по известным параметрам наносят начальное состояние рабочего тела, затем проводят линию процесса и определяют его параметры в конечном состоянии. Далее вычисляются требуемые показатели.
Задача 3
Для решения необходимо изучить общие понятия о паре, как реальном газе, процессы парообразования, таблицы и диаграммы v-Р, s-T и s-i водяного пара, циклы Карно и Ренкина для паросиловых установок.
Задачу решать с помощью диаграммы s-i для водяного пара. Представить ее графическое решение в координатах s-i.
Условия задачи:
Показать сравнительным расчетом целесообразность применения пара высоких начальных параметров и низкого конечного давления на примере паросиловой установки, работающей по циклу Ренкина, определив располагаемый теплоперепад, термический КПД цикла и удельный расход пара для двух различных значений начальных и конечных параметров пара. Указать конечное значение степени сухости x2 (при давлении Р2).
Дано:
1 вариант 2 вариант
P1 =1,0 МПа; P1 =10 МПа;
t1 =280 ° С; t1 =550 ° С;
P2 =0,08 МПа; P2 =0,004 МПа.
Определить:
1 вариант 2 вариант
i1-i2;  ; d; x2. i1-i2;
; d; x2. i1-i2; 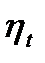 ; d; x2.
; d; x2.
Решение:
Термический КПД цикла Ренкина выражается формулой:
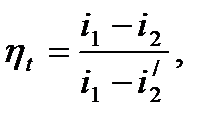
где i1 - энтальпия перегретого пара, кДж/кг; i2 - энтальпия пара в конце расширения, кДж/кг;  - энтальпия конденсата, определяется выражением:
- энтальпия конденсата, определяется выражением:

Здесь Ср =4,19 кДж/(кг∙К) - теплоемкость конденсата; t2 - температура конденсата при давлении Р2.
Величину i1-i2 называют располагаемым теплоперепадом, за счет которого производится полезная работа в цикле Ренкина. Величина 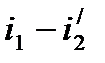 отражает количество теплоты, затраченное в цикле Ренкина.
отражает количество теплоты, затраченное в цикле Ренкина.
 Для определения значения энтальпии i1, находят на диаграмме s-i водяного пара (рис. 10) изобару P1 и изотерму t1. Пересечение этих линий образует точку 1 (рис.11), отражающую состояние перегретого пара. По этой точке на оси ординат определяется величина i1.
Для определения значения энтальпии i1, находят на диаграмме s-i водяного пара (рис. 10) изобару P1 и изотерму t1. Пересечение этих линий образует точку 1 (рис.11), отражающую состояние перегретого пара. По этой точке на оси ординат определяется величина i1.
Так как в цикле Ренкина процесс расширения пара осуществляется по адиабате (изоэнтропно), то на диаграмме s-i он изобразится вертикальной линией 1-2. В свою очередь, при пересечения адиабаты 1-2 с изобарой P2 получаем точку 2, отражающую состояние пара в конце расширения. По этой точке на оси ординат определяется величина энтальпии i2.
После этого отработавший пар конденсируется при неизменном давлении Р2 и соответствующей этому давлению температуре t2.
При степени сухости x=1 (точка 3) изотерма отклоняется вправо от изобары. Эта изотерма соответствует значению t2.
Линия постоянной степени сухости, проходящая через точку 2, соответствует величине x2.
По заданным значениям параметров из диаграммы s-i (рис.6); следует:
1 Вариант 2 Вариант
i1 = 3010 кДж/кг; i1 = 3510 кДж/кг;
i2 = 2520 кДж/кг; i2 = 2040 кДж/кг;
t2 = 95 ° С; t2 = 29 ° С;
x2 = 0,935; x2 = 0,788;
i1-i2 =3010-2520=490 кДж/кг; i1-i2 =3510-2040=1470 кДж/кг;
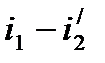 =3010-4,19∙95=2612 кДж/кг;
=3010-4,19∙95=2612 кДж/кг; 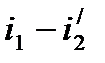 =3510-4,19∙29=3390 кДж/кг;
=3510-4,19∙29=3390 кДж/кг;
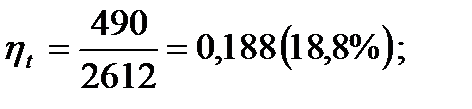


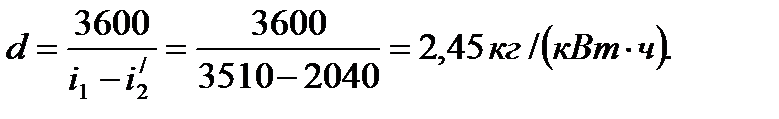
Здесь 3600 - эквивалент 1 кВт∙ч в кДж.
Контрольный вопрос:
Дополнительно к решению задачи изобразить схему простейшей паросиловой установки и дать краткое описание ее работы. Представить цикл Ренкина в координатных осях v-Р и s-T.