14.1. Окислители и восстановители
Окислительно-восстановительные реакции протекают с одновременным повышением и понижением степеней окисления элементов и сопровождаются передачей электронов:
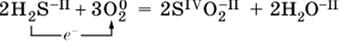 |
Повышение степени окисления элемента в ходе реакции, отвечающее потере электронов атомами этого элемента, называют окислением: S-II – 6е- = SIV. В данном примере S-II окисляется до SIV.
Понижение степени окисления элемента в ходе реакции, отвечающее присоединению электронов атомами этого элемента, называется восстановлением: O0 + 2е- = О-II. В данном примере О0 восстанавливается до O-II.
Вещество, частицы которого содержат окисляющиеся атомы, выполняет в реакции
функцию восстановителя. В данном примере восстановитель – сероводород H2S.
Вещество, частицы которого содержат восстанавливающиеся атомы, выполняет в реакции
функцию окислителя. В данном примере окислитель – молекулярный кислород O2.
Вещества, являющиеся окислителями или восстановителями во многих реакциях, называются типичными (сильными).
Многие вещества могут проявлять как окислительные, так и восстановительные свойства. К таким веществам принадлежат соединения, содержащие элементы в промежуточной (для них) степени окисления:
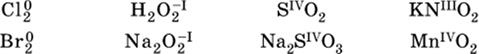 |
Окислительно-восстановительные свойства веществ связаны с положением элементов в Периодической системе Д. И. Менделеева. Простые вещества – неметаллы обладают бóльшими окислительными свойствами, а металлы – бóльшими восстановительными свойствами (O2, Cl2 – окислители; Na, Ва, Al и Zn – восстановители).
В каждой группе Периодической системы элемент с большим порядковым номером будет обладать и бóльшими восстановительными свойствами в своей группе, а элемент с меньшим порядковым номером – бóльшими окислительными свойствами. Так, кальций Са – более сильный восстановитель, чем магний Mg, молекулярный хлор Cl2 – более сильный окислитель, чем иод I2.
Соединения, содержащие атомы элементов в низкой степени окисления, будут восстановителями за счет этих атомов, например: NH3 – восстановитель за счет азота (-III), H2S
– за счет серы (-II), KI – за счет иода (-I) и т. д.
Соединения, включающие атомы элементов в высокой степени окисления, будут окислителями, например: HNO3 – окислитель за счет азота (+V), КMnO4 – за счет марганца (+VII), К2Cr2O7 – за счет хрома (+VI) и т. д.
14.2. Подбор коэффициентов методом электронного баланса
Метод состоит из нескольких этапов.
1. Записывают схему реакции; находят элементы, повышающие и понижающие свои степени окисления, и выписывают их отдельно:
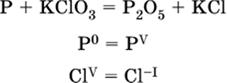
2. Составляют уравнения полуреакций окисления и восстановления:
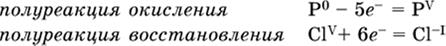 |
3. Подбирают дополнительные множители (справа за чертой) для уравнений полуреакций так, чтобы число электронов, отданных восстановителем, стало равным числу электронов, принятых окислителем:
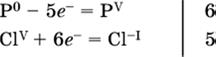 |
4. Проставляют найденные множители в качестве коэффициентов в схему реакции:
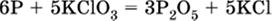 |
5. Проводят проверку по элементу, который не менял свою степень окисления (чаще всего
– кислород):
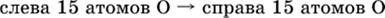 |
Примеры:
а)
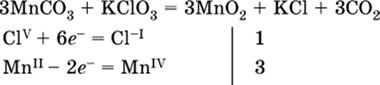
(коэффициент перед СO2 подбирается поэлементно и в последнюю очередь, проверка –
по кислороду); б)
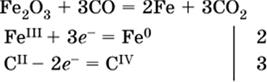
в)
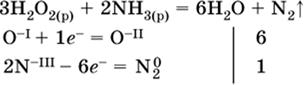
(простые вещества – здесь N2 – пишут в уравнениях полуреакций в молекулярном виде); г)
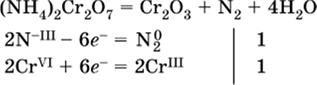
(реакция внутримолекулярного окисления-восстановления, расчет ведут на число атомов в формульной единице реагента – 2N-IIIи 2CrVI);
д)
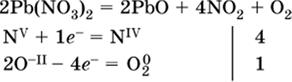
e)
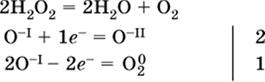
(реакция дисмутации, коэффициенты ставят сначала в правую часть уравнения); ж)
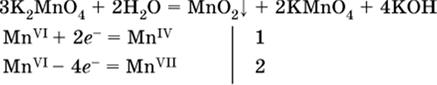
(коэффициент перед К2MnO4 находят суммированием числа атомов MnVI в правой части обоих уравнений полуреакций);
з)
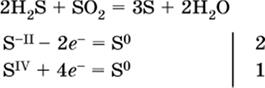
(реакция конмутации, коэффициенты ставят сначала в левую часть уравнения); и)
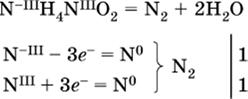
к)
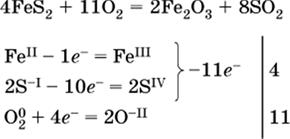
(в FeS2 окисляются атомы FeII FeIII и S-I → SIV, расчет ведут на число этих атомов в формульной единице реагента и суммируют число отданных электронов);
л)
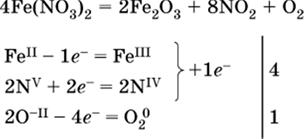
(в реагенте одновременно окисляются атомы первого слева и восстанавливаются атомы второго слева элементов: FeII → FeIII и NV → NIV, расчет ведут на число этих атомов в формуле реагента и алгебраически суммируют число электронов);
м)
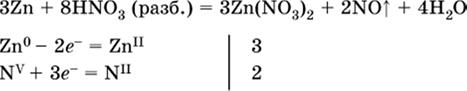
(коэффициент для HNO3 находят суммированием числа атомов N в правой части уравнения);
н)
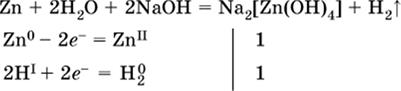
(в растворе Zn – восстановитель, H2O – окислитель; в молекуле воды восстанавливается один атом водорода из двух: НIОН – Н0);
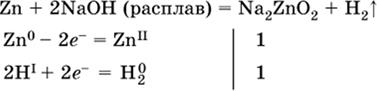 |
(в расплаве восстанавливается атом водорода из гидроксид-иона [ОНI]- → Н0).
14.3. Ряд напряжений металлов
В ряду напряжений металлов стрелка отвечает уменьшению восстановительной способности металлов и увеличению окислительной способности их катионов в водном растворе (кислотная среда):
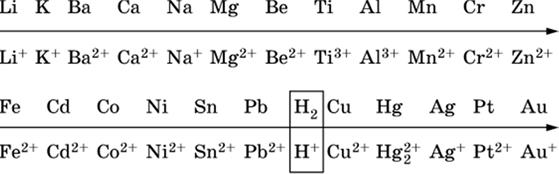
Ряд напряжений позволяет установить:
1) будет ли протекать реакция между металлом и водой; металлы, стоящие в ряду левее
Mg, т. е. Li, К, Ва, Са и Na, реагируют с водой по уравнениям:
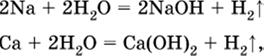 |
остальные металлы в обычных условиях не реагируют с водой;
2) будет ли протекать реакция с выделением Н2 между металлом и кислотой, которая является окислителем за счет катионов Н+, такими как НCl и H2SO4 (разб.).
С НCl (разб.) и H2SO4 (разб.) реагируют почти все металлы, стоящие левее водорода, например:
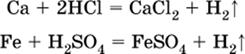 |
Исключения: металлы Ti и Sn реагируют только с НCl (конц.):
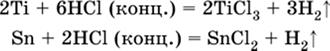 |
и не реагируют с H2SO4 (разб.). Металл Pb, восстановительная активность которого почти равна таковой для водорода, не реагирует с НCl (разб., конц.) и H2SO4 (разб.).
Металлы, стоящие в ряду напряжений правее водорода – Cu, Hg, Ag, Pt и Au, в принципе не вступают во взаимодействие с НCl и H2SO4 (разб.) и не вытесняют из них водорода.
Внимание! Из распространенных кислот в реакции с вытеснением водорода не вступают азотная кислота HNO3 (ни концентрированная, ни разбавленная) и серная кислота H2SO4 (конц.);
3) будет ли протекать реакция замещения между металлом и солью другого металла в ее растворе; чем левее находится металл в ряду напряжений, тем легче он переходит в состояние катиона и восстанавливает все металлы, стоящие справа от него (положение металлов относительно водорода не имеет значения). Так, Fe вытесняет металлы Cd – Au (по ряду слева направо) из растворов их солей.
Примеры:
а)
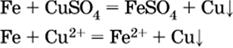
б)
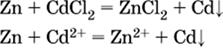
в)
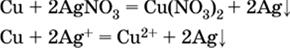
В этих реакциях не используют металлы Li – Na (левая часть ряда), которые будут реагировать не с солями других металлов в растворе, а с водой.
14.4. Электролиз расплава и раствора
Электролизом называется окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через растворы или расплавы электролитов.
На отрицательно заряженном электроде – катоде происходит электрохимическое
восстановление частиц (атомов, молекул, катионов), а на положительно заряженном электроде
– аноде идет электрохимическое окисление частиц (атомов, молекул, анионов).
Примеры электролиза расплавов:
а)
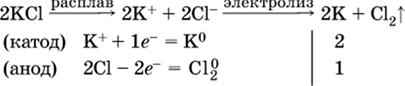
б)
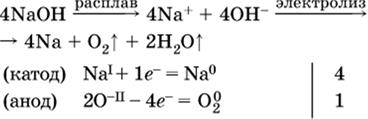
Электролиз воды проводится всегда в присутствии инертного электролита (для увеличения электропроводности очень слабого электролита – воды):
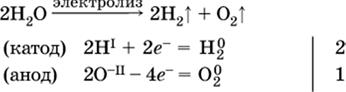 |
В зависимости от инертного электролита электролиз проводится в нейтральной, кислотной или щелочной среде (например, в присутствии K2SO4, H2SO4 или КОН).
При выборе инертного электролита необходимо учесть, что никогда не восстанавливаются на катоде в водном растворе катионы металлов, являющихся типичными восстановителями (например, Li+, К+, Са2+, Na+, Mg2+, Al3+), и никогда не окисляется на аноде кислород О-II анионов оксокислот с элементом в высшей степени окисления (например, ClO4-, SO42-, NO3-, РО43-, CO32-); вместо них окисляется вода.
Примеры электролиза растворов солей:
а)
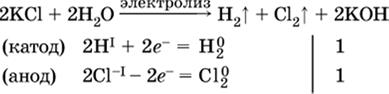
(на аноде окисляются анионы Cl-, а не кислород О-II молекул Н2O, так как электроотрицательность хлора меньше, чем у кислорода, и следовательно, хлор отдает электроны легче, чем кислород);
б)
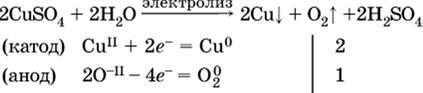
(на катоде восстанавливаются катионы Cu2+, а не водород НI молекул Н2O, так как медь стоит правее водорода в ряду напряжений, т. е. легче принимает электроны, чем НI в воде; подробнее см. 5.3).
Подчеркнем еще раз, что электролиз – это окислительно-восстановительная реакция, которая протекает под действием и при участии электрического тока. Уравнения электрохимических реакций отражают те процессы, которые без помощи электрического тока протекать не могут.
Примеры заданий частей А, В, С
1. В уравнении реакции
CuS + HNO3 (конц.) → CuSO4 + NO2↑ +… коэффициент у формулы окислителя равен
1) 1
2) 4
3) 8
4) 11
2. В уравнении реакции
К2Cr2O7 + НCl → CrCl3 + Cl2↑ +… коэффициент у формулы восстановителя – это
1) 14
2) 10
3) 6
4) 2
3―4. В уравнении реакции
3. Al + V2O5 → Al2O3 + V
4. MgC2 + Cl2 → MgCl2 + СCl4 сумма коэффициентов равна 1) 8
2) 13
3) 18
4) 24
5–6. В уравнении реакции
5. КMnО4 + Н2O + K2SO4 → MnO2↓ + K2SO4 + KOH
6. KI + H2O + Cl2 → KIO3 + HCl
сумма коэффициентов равна
1) 9
2) 10
3) 13
4) 14
7. Укажите соответствие между веществом (формула подчеркнута) и его функцией в реакции.
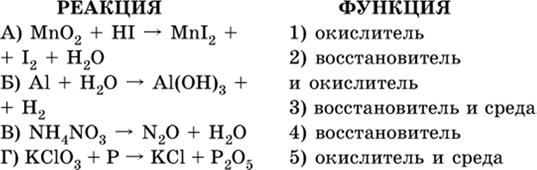 |
8. При электролизе расплава смеси гидроксида и хлорида калия набор продуктов на электродах – это
1) Н2, O2
2) К, O2
3) K, Cl2
4) Н2, Cl2
9. При электролизе раствора нитрата ртути (II) набор продуктов на электродах – это
1) Hg, O2 2) H2, O2
3) Hg, N2 4) H2, N2
10. Установите соответствие между веществом и продуктом, образующимся на катоде при электролизе раствора
 |
11. Установите соответствие между веществом и продуктом, образующимся на аноде при электролизе раствора

12–14. Используя метод электронного баланса, составьте уравнение реакции по указанной схеме. Определите окислитель и восстановитель.
12. Mn(NO3)2 + HNO3 + РЬO2 → HMnO4 + Pb(NO3)2 +…
13. Zn + H2SO4 + HNO3 (разб.) → ZnSO4 + NO +…
14. K2Cr2O7 + HCl + C2H5OH → CrCl3 + CH3C(H)O +…
 |
Ответы
1. 3. 2. 1. 3. 4. 4. 1. 5. 3. 6. 4. 7. А-3, Б-5, В-2, Г-1. 8. 3. 9. 1. 10. А-4, Б-3, В-6, Г-4. 11. А-4, Б-6, В-2, Г-6. 12. 2Mn(NO3)2 + 6HNO3 + 5РЬO2 = 2HMnO4 + 5Pb(NO3)2 + 2H2O. Окислитель РЬO2, восстановитель Mn(NO3)2. 13. 3Zn + 3H2SO4 + 2HNO3 (разб.) = 3ZnSO4 + 2NO + 4H2O.
Окислитель HNO3, восстановитель Zn. 14. K2Cr2O7 + 8HCl + 3C2H5OH = 2CrCl3 + 3CH3C(H)O + 7H2O + 2KCl. Окислитель K2Cr2O7, восстановитель C2H5OH.