Глава I. Химическая термодинамика
1. Определить тепловой эффект химической реакции в стандартных условиях при 500 К: СН3ОН + 3/2 О2(г) = СO2(г) + 2Н2O
Решение:
Из справочника [8] выпишем необходимые для расчёта термодинамические величины
| Вещество | СO2 (г) | Н2O (г) | O2 (г) | СН3ОH (г) |
| ΔН0f, 298 кДж/моль | -393,51 | -241,84 | -201,20 | |
| С0р, 298 Дж/мольК | 37,13 | 33,56 | 29,36 | 43,90 |
Для расчёта теплового эффекта и изменения теплоёмкости применим следствие из закона Гесса, при этом учитываем, что для простых веществ стандартная теплота образования равна нулю.
ΔH0298, х.р. = ΣνiΔH0298,f (прод) – ΣνiΔH0 298, f (исх)
ΔH0298, х.р. = ΔН0298, f (  ) + 2ΔН0298, f (
) + 2ΔН0298, f (  ) – ΔН0298, f (
) – ΔН0298, f (  ) =
) =
= (– 393,51) + 2(–241,84) – (–201,2) = – 675,99 кДж.
Знак минус перед тепловым эффектом означает, что теплота выделяется в результате реакции.
ΔС0р, 298 = (Ср(  ) + 2Ср(
) + 2Ср(  )) – (Ср(
)) – (Ср(  ) – Ср(
) – Ср(  )) =
)) =
= (37,13 + 2·33,56) – (43,9 + 3/2·29,36) = 16,31 Дж/К
Тепловой эффект при 500 К находим по уравнению Кирхгофа (второе приближение), при условии, что средняя изобарная теплоемкость постоянна
Ср = C0p298 = const.
ΔН0500 х.р. = 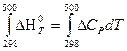 = ΔН0298 +
= ΔН0298 +  = ΔН0298 + ΔCp (500 – 298) =
= ΔН0298 + ΔCp (500 – 298) =
= – 675,99·103 + 16,31(500 – 298) = 672,70·103 Дж = 672,7 кДж
2. Рассчитать (по теплотам сгорания) стандартную теплоту образования глицерина С3Н8О3 (ж).
Решение:
Из определения теплоты образования следует, что H298, f ( 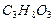 ) – это тепловой эффект реакции:
) – это тепловой эффект реакции:
3С(гр) + 4Н2 + 3/2 О2 = С3H8О3 (ж),
используя следствие из закона Гесса, можно записать:
Δ H298, f ( 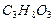 ) = 3ΔHсгор (
) = 3ΔHсгор ( 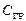 ) + 4ΔН сгор (
) + 4ΔН сгор ( 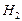 ) – ΔН сгор (
) – ΔН сгор ( 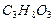 )
)
Теплоты сгорания простых веществ при стандартных условиях численно равны стандартным теплотам образования продуктов сгорания, т.е. для реакций
Н2 + 0,5 О2 = Н2О(ж) и С + О2(г) = СО2(г)
из справочника [8] определяем:
ΔН298, сгор ( 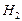 ) = ΔН298, f (
) = ΔН298, f (  ) = – 285,83 кДж/моль
) = – 285,83 кДж/моль
ΔН298, сгор ( 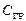 ) = ΔH298, f (
) = ΔH298, f (  ) = – 393,51 кДж/моль
) = – 393,51 кДж/моль
ΔН298, сгор ( 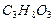 ) = – 1661,05 кДж/моль
) = – 1661,05 кДж/моль
ΔНf, 298 ( 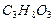 ) = [3(– 393,51)+4(– 285,83)] – [– 1661,05] = – 602,8 кДж/моль
) = [3(– 393,51)+4(– 285,83)] – [– 1661,05] = – 602,8 кДж/моль
По справочным данным эта величина равна – 668,6 Кдж/моль.
3. Дайте заключение о возможности самопроизвольного протекания химической реакции при Т = 298 К
фермент

молочная кислота пировиноградная к-та
| Вещество | ΔH298, f кДж/моль | S298, f, Дж/моль·К |
| молочная кислота | -673 | |
| пировиноградная к-та | -586 | |
| Н2 |
Решение:
Рассчитаем по следствию из закона Гесса:
1. Изменение энтальпии: ΔН0298, р = (– 586 + 0) – (– 673) = 87 (кДж)
2. Изменение энтропии: ΔS0298, p = (179 + 130) – 192 =117 (Дж/К)
3. Изменение энергии Гиббса по уравнению Гиббса-Гельмгольца (первое приближение):
ΔG0298 = ΔH0298 – TΔS = 87·103 – 298·117 = 52134 (Дж) ~52,1 кДж
реакция самопроизвольно протекать не может, т.к. ΔG0298 > 0
4. При 1000 К и 1,013·105 Па из исходной смеси, содержащей 1 моль SО2 и 0,6 моль О2 при достижении равновесия образовалось 0,22 моль SО3. Определить Кр для реакции
2SО2 + О2  2SО3
2SО3
Решение:
На образование 0,22 моль SО3, согласно уравнению реакции израсходовано 0,22 моль SО2 и 0,11 моль кислорода. Запишем число молей
| SО2 | О2 | SО3 | |
| В исходной смеси | 0,6 | ||
| Прореагировало/образовалось | 0,22 | 0,11 | 0,22 |
| В равновесной смеси | 1 – 0,22 = 0,78 | 0,6 – 0,11 = 0,49 | 0,22 |
| Συi | 0,78 + 0,49 + 0,22 = 1,49 |
P(  ) = n(
) = n(  )·Pобщ = (0,78/1,49)·1,013·105 = 5,31·104 Па
)·Pобщ = (0,78/1,49)·1,013·105 = 5,31·104 Па
Р(  ) = n(
) = n(  )·Pобщ = (0,49/1,49)·1,013·105 = 3,22·104 Па
)·Pобщ = (0,49/1,49)·1,013·105 = 3,22·104 Па
P(  ) = n(
) = n(  )·Pобщ= (0,22/1,49)·1,013·105 = 1,5·104 Па
)·Pобщ= (0,22/1,49)·1,013·105 = 1,5·104 Па

5. Для реакции: СО + Cl2  COCl2 при 600 °С константа равновесия равна 6,386. В каком направлении будет протекать реакция, если в 1 л реакционной смеси находится
COCl2 при 600 °С константа равновесия равна 6,386. В каком направлении будет протекать реакция, если в 1 л реакционной смеси находится
а) 1моль СО; 1 моль Cl2; 4 моль COCl2
б) 1моль СО; 1 моль Сl; 8 моль COCl2
в) 1моль СО; 1,565 моль Cl2; 10 моль COCl2
Решение:
Воспользуемся уравнением изотермы химической реакции.

а) ΔG = – RTln·6,386 + RT·ln 4
He производя вычислений, а лишь сравнивая величины, стоящие за знаком логарифма, можно сделать вывод, что G < 0. Это значит, что при смешивании реагирующих веществ в указанных соотношениях реакция пойдёт в сторону образования СОCl2;
б) ΔG = – RTln 6,386 + RTln 8
Сравнив оба слагаемых, можно сделать вывод, что ΔG > 0. Это значит, что при смешивании реагирующих веществ в указанных соотношениях реакция пойдёт в сторону образования СО и Cl2;
в) ΔG = – RTln 6,386 + RTln 6,386
Сравнив оба слагаемых, можно сделать вывод, что ΔG = 0. В этом случае система находится в состоянии химического равновесия.
6. Рассчитать значение константы равновесия для реакции при стандартных условиях и 1000 К, если изменение энергии Гиббса равно – 100,79 кДж.
0,5 Н2(г) + 0,5 Сl2(г) = НCl(г)
Решение:
Воспользуемся уравнением изотермы при стандартных условиях.
–ΔGT0 = RTlnKp
lgKp = (– ΔG0T) / (2,3·RT) = (–100,79) / (2,3·8,31·1000) = 5,27
Кр = 1,86·105.